Nêu cách pha chế 604g dung dịch KCl bão hòa ở 80oC từ KCl và nước. Biết SKCl(80oC) = 51g

Những câu hỏi liên quan
BT2:
a) Nêu cách pha chế 300 gam dung dịch KCL 5% từ dung dịch KCL 15%
b) Nêu cách pha chế 200 ml dung dịch BACl2 1M từ dung dịch BaCl2 2M
a) m KCl = 300.5% = 15(gam)
m dd KCl = 15/15% = 100(gam)
m nước cần thêm = 300 - 100 = 200(gam)
Pha chế :
- Chuẩn bị 100 gam dung dịch KCl 15% vào cốc 1 lít
- Đong thêm 200 gam nước vào cốc,khuấy đều
b) n BaCl2 = 0,2.1 = 0,2(mol)
V dd BaCl2 2M = 0,2/2 = 0,1(lít) = 100(ml)
V nước cần thêm = 200 - 100 = 100(ml)
Pha chế :
- Chuẩn bị 100 ml dd BaCl2 2M vào cốc 500 ml
- Đong thêm 100 ml nước vào cốc,khuấy đều
Đúng 1
Bình luận (0)
Câu 2: (5,5đ)1. Biết độ tan của CuSO4 ở 5oC là 15g và ở 80oC là 50g. Người ta làm lạnh 600g dung dịch CuSO4 bão hòa ở 80oC xuống 5oC. Tính khối lượng CuSO4.5H2O kết tinh?2. Cô cạn 160g dung dịch CuSO4 10% đến khi tổng số nguyên tử trong dung dịch chỉ còn một nửa so với ban đầu thì dừng lại. Tính khối lượng nước bay ra?
Đọc tiếp
Câu 2: (5,5đ)
1. Biết độ tan của CuSO4 ở 5oC là 15g và ở 80oC là 50g. Người ta làm lạnh 600g dung dịch CuSO4 bão hòa ở 80oC xuống 5oC. Tính khối lượng CuSO4.5H2O kết tinh?
2. Cô cạn 160g dung dịch CuSO4 10% đến khi tổng số nguyên tử trong dung dịch chỉ còn một nửa so với ban đầu thì dừng lại. Tính khối lượng nước bay ra?
2
160 gam dung dịch CuSO4 chứa mCuSO4=160.10%=16 gam
-> nCuSO4=16/160=0,1 mol
-> mH2O=160-16=144 gam -> nH2O\(=\dfrac{144}{18}\)=8 mol
-> số mol các nguyên tử trong dung dịch=8.3+0,1.6=24,6 mol
-> Sau khi cô cạn số mol các chất =\(\dfrac{24,6}{2}\)=12,3 gam
-> nH2O thoát ra =\(\dfrac{12,3}{3}\)=4,1 mol -> mH2O=4,1.18=73,8 gam
Đúng 2
Bình luận (1)
Câu 2: (5,5đ)1. Biết độ tan của CuSO4 ở 5oC là 15g và ở 80oC là 50g. Người ta làm lạnh 600g dung dịch CuSO4 bão hòa ở 80oC xuống 5oC. Tính khối lượng CuSO4.5H2O kết tinh?2. Cô cạn 160g dung dịch CuSO4 10% đến khi tổng số nguyên tử trong dung dịch chỉ còn một nửa so với ban đầu thì dừng lại. Tính khối lượng nước bay ra?
Đọc tiếp
Câu 2: (5,5đ)
1. Biết độ tan của CuSO4 ở 5oC là 15g và ở 80oC là 50g. Người ta làm lạnh 600g dung dịch CuSO4 bão hòa ở 80oC xuống 5oC. Tính khối lượng CuSO4.5H2O kết tinh?
2. Cô cạn 160g dung dịch CuSO4 10% đến khi tổng số nguyên tử trong dung dịch chỉ còn một nửa so với ban đầu thì dừng lại. Tính khối lượng nước bay ra?
Câu 2:
1.
\(m_{H_2O}=\dfrac{600}{100+50}.100=400\left(g\right)\\ m_{CuSO_4\left(kết.tinh\right)}=\dfrac{400}{100}.\left(50-15\right)=140\left(g\right)\\ n_{CuSO_4.5H_2O}=n_{CuSO_4}=\dfrac{140}{160}=0,875\left(mol\right)\\ m_{CuSO_4.5H_2O\left(kết.tinh\right)}=0,875.250=218,75\left(g\right)\)
2,
Số nguyên tử bằng một nửa ban đầu => số mol giảm đi một nửa
\(m_{CuSO_4}=160.10\%=16\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\\ m_{H_2O}=160-16=144\left(g\right)\Rightarrow n_{H_2O}=\dfrac{144}{18}=8\left(mol\right)\\ \Rightarrow n_{H_2O\left(bay.hơi\right)}=\dfrac{1}{2}.\left(0,1+8\right)=4,05\left(mol\right)\\ \Rightarrow m_{H_2O\left(bay.hơi\right)}=4,05.18=72,9\left(g\right)\)
Đúng 1
Bình luận (0)
giúp em câu này với ạ,em đang cần gấp,em cảm ơn.
a/Có bao nhiêu gam muối ăn có trong 5kg dung dịch bão hòa muối ăn ở 20°C,biết S=35,9g
b/biết dộ tan của KCl ở 20°C là 34g.Tìm khối lượng KCl và khối lượng nước có trong 67g dung dịch KCl bão hòa.
\(\dfrac{S}{S+100}=\dfrac{m_{ct}}{m_{bãohòa}}\Rightarrow\dfrac{35,9}{35,9+100}=\dfrac{m_{ct}}{5\cdot1000}\)
\(\Rightarrow m_{ct}=1320,824g=1,32kg\)
Đúng 1
Bình luận (0)
Xác định lượng tinh thể Na2SO4.10H2O tách ra khi làm nguội 1026,4g dung dịch bão hòa ở 80oC xuống 10oC. Biết độ tan của Na2SO4 khan ở nhiệt độ 80oC là 28,3g và ở 10oC là 9g
hóa 8
help me
Khi làm nguội 1026,4 gam dung dịch bão hòa
R
2
S
O
4
từ
80
o
C
xuống
10
o
C
thì có 395,4 gam tinh thể
R
2
S
O
4
.
n
H
2
O
tách ra khỏi dung dịch (trong đó R là kim loại kiềm và n nguyên, thỏa mãn điều kiện 7 n 12). Biết độ tan...
Đọc tiếp
Khi làm nguội 1026,4 gam dung dịch bão hòa R 2 S O 4 từ 80 o C xuống 10 o C thì có 395,4 gam tinh thể R 2 S O 4 . n H 2 O tách ra khỏi dung dịch (trong đó R là kim loại kiềm và n nguyên, thỏa mãn điều kiện 7< n < 12). Biết độ tan của R 2 S O 4 ở 80 o C và 10 o C lần lượt là 28,3 gam và 9 gam. Công thức phân tử của hiđrat nói trên là
A. Cu
B. Na
C. Al
D. K
Chọn B
Độ tan của R 2 S O 4 ở 80 o C là 28,3 gam
→ Trong 1026,4 gam dung dịch có
m R 2 S O 4 = 1026,4.28,3 100 + 28,3 = 226,4 g

Vậy kim loại R là Na.
Đúng 0
Bình luận (0)
Người ta pha chế một dung dịch NaCl ở
20
0
C
bằng cách hòa tan 23,5g NaCl trong 75g nước. Căn cứ vào độ tan của NaCl trong nước
S
N
a
C
l
20
0
C
32
g
,hãy cho biết dung dịch NaCl đã pha chế là bão hòa hay chưa bão hòa? Nếu...
Đọc tiếp
Người ta pha chế một dung dịch NaCl ở 20 0 C bằng cách hòa tan 23,5g NaCl trong 75g nước. Căn cứ vào độ tan của NaCl trong nước S N a C l 20 0 C = 32 g ,hãy cho biết dung dịch NaCl đã pha chế là bão hòa hay chưa bão hòa? Nếu dung dịch NaCl là chưa bão hòa, làm thế nào để có được dung dịch NaCl bão hòa ở 20 0 C ?
Ở 20 0 C thì 75g nước hòa tan tối đa muối NaCl có khối lượng:
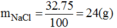
Vậy dung dịch NaCl đã pha chế là chưa bão hòa. Để dung dịch NaCl bão hòa ở nhiệt độ này, ta cần cho thêm vào dung dịch đã pha chế một lượng NaCl là: 24-23,5=0,5(g)
Đúng 2
Bình luận (0)
xác định m KCl kết tinh khi làm nguội 604g dung dịch KCl bão hòa ở 800C và 200C.Biết độ tan KCl ở 800C là 51g và 200C là 34g
*Ở 90oc
Cứ 100g nước thì hòa tan tối đa được 51g KCl để tạo thành 151g ddKCl bão hòa
Cứ x(g)nước thì hòa tan tối đa được y(g)KCl để tạo thành 604g dd KCl bão hòa
⇒mH2O/90o = x = \(\dfrac{604.100}{151}=400\) (g)
⇒mKCl/90o = y = mdd - mH2O = 604-400=204 (g)
ta có :
mH2O/10o = mH2O/90o = 400 (g)
*Ở 10oc :
Cứ 100g nước hòa tan tối đa 34 g KCl
Vậy 400g nước hòa tan tối đa z (g) KCl
⇒mKCl/10o = z =\(\dfrac{400.34}{100}136\) (g)
⇒mKCl/kt = mKCl/90o - mKCl/10o =204 -136 = 68 (g)
Vậy khối lượng của KCl kết tinh là : 68 g
Đúng 0
Bình luận (0)
Tính khối lượng chất tan cần dùng để pha chế các dung dịch sau:
a. 300 ml dung dịch KCl 2M.
b. 20 gam dung dịch NaOH 25%.
c. 100 gam dung dịch MgCl2 bão hòa biết độ tan của MgCl2 là 53,6 gam.
a) \(n_{KCl}=0,3.2=0,6\left(mol\right)\)
=> \(m_{KCl}=0,6.74,5=44,7\left(g\right)\)
b) \(m_{NaOH}=20.25\%=5\left(g\right)\)
c) \(S=\dfrac{m_{ct}}{m_{dd}}.100\)
=> \(53,6=\dfrac{m_{MgCl_2}}{100}.100\)
=> mMgCl2 = 53,6 (g)
Đúng 3
Bình luận (0)


















