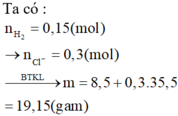Hỗn hợp A gồm 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng hết với H2O được dung dịch B. Thêm vào B 100 ml dung dịch HCl 0,8M. Sau đó thêm tiếp 0,8g NaOH để trung hòa HCl dư được dung dịch C. Cô cạn C được 5,4g muối. Xác định 2 kim loại kiềm và khối lượng mỗi kim loại.

Những câu hỏi liên quan
Cho 8,8g hỗn hợp 2 kim loại A,B thuộc nhóm IIA và ở 2 chu kì liên tiếp tác dụng vừa đủ với dung dịch HCl dư thu được dung dịch D và V (lít) H2 . Nếu thêm 0,5 mol AgNO3 vào dung dịch D thì chưa kết tủa hết A, B. Nếu thêm 0,7 mol vào dung dịch D thì AgNO3 dư. Xác định A, B.
Cho m gam hỗn hợp X gồm 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng với 180 ml dung dịch
Al
2
SO
4
3
1M thu được 15,6 gam kết tủa; khí
H
2
và dung dịch A. Nếu cho m gam hỗn hợp X tác dụng với 240 gam dung dịch HCl 18,25% thu được dung dịch B và
H
2
. Cô cạn dung dịch...
Đọc tiếp
Cho m gam hỗn hợp X gồm 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng với 180 ml dung dịch Al 2 SO 4 3 1M thu được 15,6 gam kết tủa; khí H 2 và dung dịch A. Nếu cho m gam hỗn hợp X tác dụng với 240 gam dung dịch HCl 18,25% thu được dung dịch B và H 2 . Cô cạn dung dịch B thu được 83,704 gam chất rắn khan. Biết rằng m < 45 gam. Phần trăm khối lượng của kim loại kiềm có nguyên tử khối nhỏ hơn trong X là
A. 48,57%.
B. 37,10%
C. 16,43%
D. 28,22%
Một hỗn hợp gồm 2 axit cùng loại với axit axetic kế tiếp nhau.Lấy m gam hỗn hợp rồi thêm vào đó 75 ml dung dịch NaOH 0,2M. Sau đó thêm 25ml dung dịch HCl 0,2M để trung hòa NaOH dư.Sau khi đã trung hòa đem cô cạn dung dịch đến khô thu được 1,0425 gam hỗn hợp các muối khan.Xác định công thức phân tử axit
Gọi CTHH chung của axit là RCOOH
Đổi: \(\left\{{}\begin{matrix}75ml=0,075l\\25ml=0,025l\end{matrix}\right.\)
\(n_{NaOH}=0,075.0,2=0,015\left(mol\right)\)
\(n_{HCl}=0,025.0,2=0,005\left(mol\right)\)
PTHH: NaOH + HCl ---> NaCl + H2O
0,005<---0,005->0,005
=> nNaOH (phản ứng với axit hữu cơ) = 0,015 - 0,005 = 0,01 (mol)
mNaCl = 0,005.58,5 = 0,2925 (g)
=> mmuối Na hữu cơ = 1,0425 - 0,2925 = 0,75 (g)
PTHH:
RCOOH + NaOH ---> RCOONa + H2O (1)
Theo pthh (1): naxit = nH2O = nNaOH = 0,01 (mol)
Áp dụng ĐLBTKL:
\(m_{axit}+m_{NaOH}=m_{muối}+m_{H_2O}\\ \Leftrightarrow m_{axit}=0,75+0,01.18-0,01.40=0,53\left(g\right)\)
=> \(M_{RCOOH}=\dfrac{0,53}{0,01}=53\left(\dfrac{g}{mol}\right)\)
=> \(M_R=53-45=8\left(\dfrac{g}{mol}\right)\)
=> \(m_{C\left(R_1\right)}< 8< m_{C\left(R_2\right)}\)
=> \(n_{C\left(R_1\right)}< \dfrac{2}{3}< n_{C\left(R_2\right)}\)
Mà số nguyên tử cacbon là số nguyên không âm
=> Một axit có 0 nguyên tử cacbon và một axit có 1 nguyên tử cacbon
=> 2 axit lần lượt là HCOOH và CH3COOH
P/s: CTHH dạng chung là CnH2n+1COOH nhé :)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm hai kim loại kiềm ở 2 chu kì liên tiếp. Lấy 8,5 gam hỗn hợp X cho tác dụng hết với dung dịch HCl dư, thu được dung dịch Y và 3,36 lít H2 (đktc). Cô cạn dung dịch Y thu được m gam chất rắn. Giá trị của m và hai kim loại kiềm lần lượt là : A. 32,6 và Na, K B. 46,8 và Li, Na C. 32,6 và Li, Na D. 19,15 và Na, K
Đọc tiếp
Hỗn hợp X gồm hai kim loại kiềm ở 2 chu kì liên tiếp. Lấy 8,5 gam hỗn hợp X cho tác dụng hết với dung dịch HCl dư, thu được dung dịch Y và 3,36 lít H2 (đktc). Cô cạn dung dịch Y thu được m gam chất rắn. Giá trị của m và hai kim loại kiềm lần lượt là :
A. 32,6 và Na, K
B. 46,8 và Li, Na
C. 32,6 và Li, Na
D. 19,15 và Na, K
Cho 16g hợp kim của Ba vào một kim loại kiềm tác dụn với H2O ta được dung dịch A và 3,36 lít khí hidro (đktc).Cần bao nhiêu ml dung dịch HCl 0,5M để trung hòa hết 1/10 dung dịch A..dung dịch vẫn còn dư là Ba nhưng nếu thêm tiếp 2ml dung dịch nữa thì thấy dư SO4.Xác định kim loại kiềm
Bài này đề không rõ ràng, thứ nhất dung dịch dư thì không thể là Ba, thứ 2 lúc thì là dd HCl sau lại là SO4.
Đúng 0
Bình luận (0)
Cho hỗn hợp hai kim loại kiềm thuộc 2 chu kỳ liên tiếp nhau trong bảng HTTH được chia làm 2 phâng bằng nhau-phần 1: tác dụng với H2O dư rồi trung hòa hết bằng dung dịch H2SO4, sau phản ứng thu được 4,58 gam muối khan--phần 2: tác dụng với H2O dư rồi trung hòa hết bằng dung dịch HCl, sau phản ứng thu được 3,83 gam muối khantìm 2 kim loại đóA. Li,NaB. Na, KC. K, RbD. Rb, Cs
Đọc tiếp
Cho hỗn hợp hai kim loại kiềm thuộc 2 chu kỳ liên tiếp nhau trong bảng HTTH được chia làm 2 phâng bằng nhau
-phần 1: tác dụng với H2O dư rồi trung hòa hết bằng dung dịch H2SO4, sau phản ứng thu được 4,58 gam muối khan
--phần 2: tác dụng với H2O dư rồi trung hòa hết bằng dung dịch HCl, sau phản ứng thu được 3,83 gam muối khan
tìm 2 kim loại đó
A. Li,Na
B. Na, K
C. K, Rb
D. Rb, Cs
xin lỗi thầy. bài này em tính toán nhầm nên đã làm lại được rồi.
Đúng 0
Bình luận (0)
Hòa tan 9,3 gam hỗn hợp 2 nhàm loại kiềm (IA) ở hai chu kì liên tiếp vào H2O dư thu được 3,36 lít khí ở đktc và dung dịch A
a) Xác định tên 2 kim loại
b) Tính V H2SO4 2M cần dùng để trung hòa hết dung dịch A, cô cạn A được bao nhiều gam muối khan?
Coi hai nguyên tố là R \(\Rightarrow\overline{M}=M_R\)
a, PTHH:
\(2R+2H_2O\rightarrow2ROH+H_2\uparrow\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_R=2n_{H_2}=0,3\left(mol\right)\)
Khi đó \(\overline{M}=M_R=\dfrac{9,3}{0,3}=31\left(g/mol\right)\)
\(\Rightarrow\) Hai nguyên tố lần lượt là Na, K
b, PTHH:
\(2ROH+H_2SO_4\rightarrow R_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{ROH}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_M}=\dfrac{0,15}{2}=0,075\left(l\right)\)
\(n_{R_2SO_4}=n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow m_{R_2SO_4}=0,15.\left(31.2+32+16.4\right)=23,7\left(g\right)\)
Đúng 1
Bình luận (0)
Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là: A. Li, Na B. Na, K C. K, Rb D. Li, K
Đọc tiếp
Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là:
A. Li, Na
B. Na, K
C. K, Rb
D. Li, K
Gọi công thức trung bình của hai muối là: M ¯ 2 CO 3
Cho từ từ hỗn hợp muối cacbonat nên ta có phản ứng:
CO 3 2 - + 2 H + → CO 2 + H 2 O
Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa H+ hết và dư CO 3 2 -
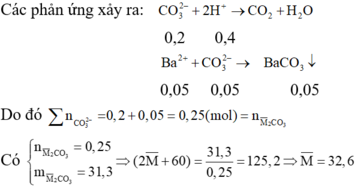
Vậy hai kim loại cần tìm là Na và K
Đáp án B.
Đúng 0
Bình luận (0)
Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là: A. Li, Na B. Na, K C. K, Rb D. Li, K
Đọc tiếp
Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là:
A. Li, Na
B. Na, K
C. K, Rb
D. Li, K
Đáp án B
Gọi công thức trung bình của hai muối là: M2CO3.
Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa à H+ hết và dư CO32-
Các phản ứng xảy ra: CO32- + 2H+ → CO2 + H2O
0,2 0,4
CO32-dư + Ba2+ → BaCO3
0,05 0,05 0,05
Đúng 0
Bình luận (0)