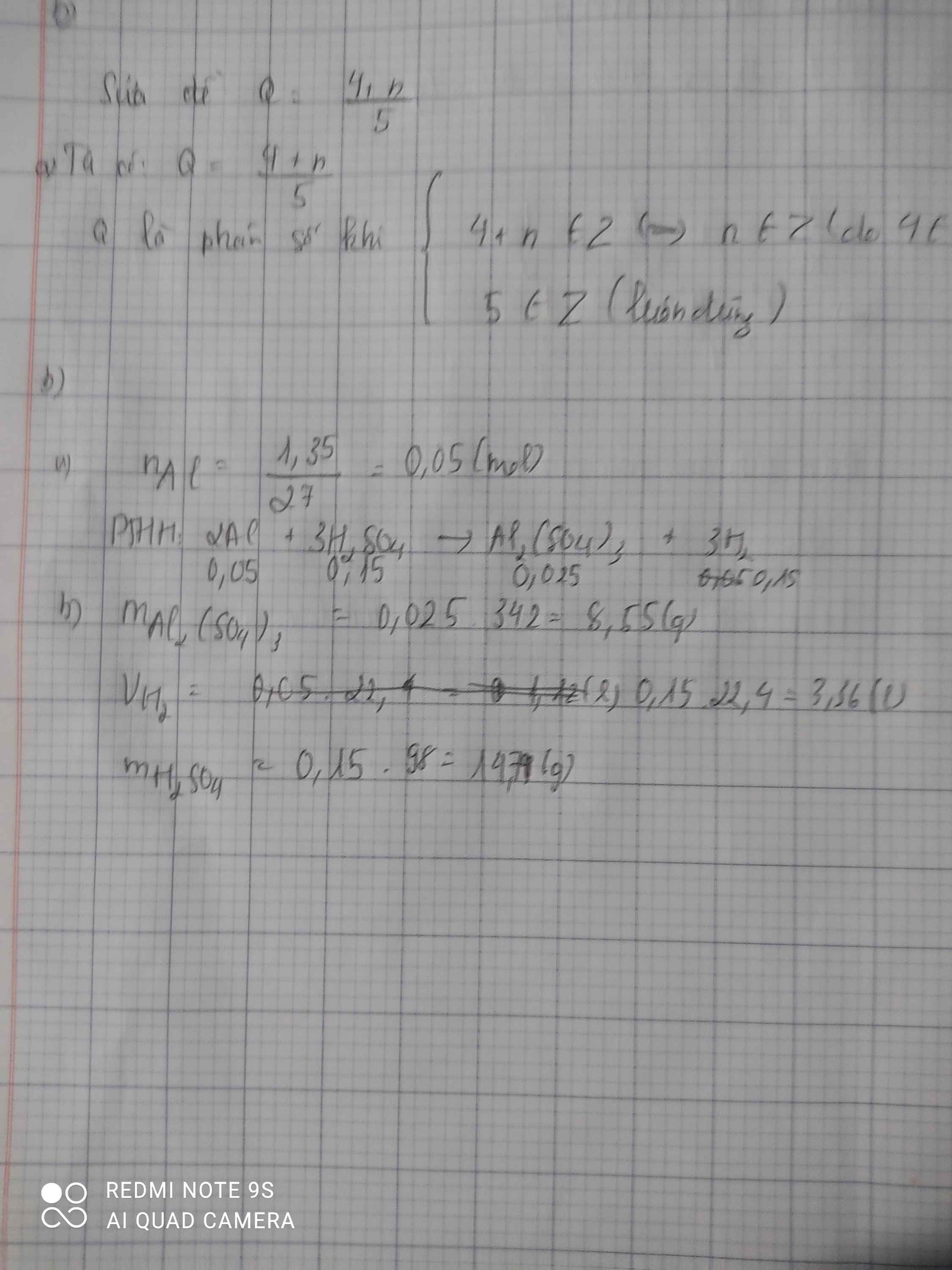Hoà tan 20,4g Al2O3 vào dung dịch chứa 17,64 g H2SO4. Tính khối lượng Al2(SO4)3

Những câu hỏi liên quan
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 17,64%.
Sau phản ứng thu được dung dịch chỉ chứa 1 chất tan là Al2(SO4) có nồng độ 19,4355% và 4,032 lít khí
(đktc). Tính % khối lượng mỗi chất trong X và khối lượng dung dịch axit đã dùng. Biết trong X oxi chiếm
42,105% về khối lượng.
1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
Đúng 0
Bình luận (0)
1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 17,64%.
Sau phản ứng thu được dung dịch chỉ chứa 1 chất tan là Al2(SO4) có nồng độ 19,4355% và 4,032 lít khí
(đktc). Tính % khối lượng mỗi chất trong X và khối lượng dung dịch axit đã dùng. Biết trong X oxi chiếm
42,105% về khối lượng. giúp mik với
1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
Đúng 1
Bình luận (1)
Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
Đúng 1
Bình luận (1)
Cho 20,4g Al2O3 tác dụng với dung dịch có chứa 78,84g H2SO4 theo sơ đồ sau:
Al2O3+H2SO4-> Al2(SO4)3+H2O
a.Tính khối lượng chất dư
b.Tính khối lượng muối Al2(SO4)3 tạo thành theo 2 cách
\(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{78,84}{98}=0,8mol\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
0,2 < 0,8 ( mol )
0,2 0,6 0,2 0,6 ( mol )
\(m_{H_2SO_4\left(dư\right)}=\left(0,8-0,6\right).98=19,6g\)
Cách 1:\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4g\)
Cách 2:
\(m_{H_2SO_4}=0,6.98=58,8g\)
\(m_{H_2O}=0,6.18=10,8g\)
Áp dụng ĐL BTKL, ta có:
\(m_{Al_2O_3}+m_{H_2SO_4}=m_{Al_2\left(SO_4\right)_3}+m_{H_2O}\)
\(\rightarrow m_{Al_2\left(SO_4\right)_3}=20,4+58,8-10,8=68,4g\)
Đúng 2
Bình luận (0)
0,2 < 0,8 ( mol )
0,2 0,6 0,2 0,6 ( mol )
Đúng 0
Bình luận (0)
hòa tan 10,8 g Al vào dung dịch chứa 22,4 g h2so4 sau phản ứng thu được Al2(SO4)3 và H2
a) tính khối lượng chất dư
b) tính khối lượng Al2(SO4)3 thu được
c) tính thể tích H2
\(n_{Al}=\dfrac{10.8}{27}=0.4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{22.4}{98}=\dfrac{8}{35}\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(2............3\)
\(0.4..........\dfrac{8}{35}\)
\(LTL:\dfrac{0.4}{2}>\dfrac{\dfrac{8}{35}}{3}\Rightarrow Aldư\)
\(m_{Al\left(dư\right)}=\left(0.4-\dfrac{8}{35}\cdot\dfrac{2}{3}\right)\cdot27=6.68\left(g\right)\)
\(m_{Al_2\left(SO_4\right)_3}=\dfrac{8}{35\cdot3}\cdot342=26.05\left(g\right)\)
\(V_{H_2}=\dfrac{8}{35}\cdot22.4=5.12\left(l\right)\)
Đúng 2
Bình luận (2)
Hoà tan hoàn toàn nhôm vào dung dịch axit H2SO4 loãng sau phản ứng thu đc dung dịch Al2(SO4)3 và 13,44(l) khí hiđro(đktc) a, tính số ngtử Al b, tính khối lượng Al2(SO4) c, tính khối lượng H2SO4 theo 2 cách
\(a,PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ \Rightarrow\text{Số nguyên tử Al là }2\\ b,n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ \Rightarrow n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2}=0,2\left(mol\right)\\ \Rightarrow m_{Al_2\left(SO_4\right)_3}=0,2\cdot342=68,4\left(g\right)\\ c,C_1:n_{H_2SO_4}=n_{H_2}=0,6\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=0,6\cdot98=58,8\left(g\right)\\ C_2:n_{Al}=\dfrac{2}{3}n_{H_2}=0,4\left(mol\right)\\ \Rightarrow m_{Al}=0,4\cdot27=10,8\left(g\right)\\ m_{H_2}=0,6\cdot2=1,2\left(g\right)\\ \text{Bảo toàn KL: }m_{H_2SO_4}=m_{Al_2\left(SO_4\right)_3}+m_{H_2}-m_{Al}=68,4+1,2-10,8=58,8\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 1,35 g kim loại nhôm (Al) tan hoàn toàn trong dung dịch axit sunfuric H2SO4 , thu được dung dịch chứa nhôm sunfat Al2(SO4)3 và khí hidro thoát ra .
b) Tính khối lượng Al2(SO4)3.
c) Tính thể tích khí Hidro (đktc)
d) Tính khối lượng H2SO4
\(n_{Al}=\dfrac{1,35}{27}=0,05\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow2Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2SO_4}=n_{H_2}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{0,05}{2}=0,025\left(mol\right)\\ a,m_{Al_2\left(SO_4\right)_3}=342.0,025=8,55\left(g\right)\\ b,V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ c,m_{H_2SO_4}=0,075.98=7,35\left(g\right)\)
Đúng 5
Bình luận (0)
\(n_{Al}=\dfrac{1,35}{27}=0,05mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,05 0,075 0,025 0,075
\(m_{Al_2\left(SO_4\right)_3}=0,025\cdot342=8,55g\)
\(V_{H_2}=0,075\cdot22,4=1,68l\)
\(m_{H_2SO_4}=0,075\cdot98=7,35g\)
Đúng 2
Bình luận (0)
hòa tan hoàn toàn 2,04 gam AL2O3 trong dung dịch H2SO4 ( lấy dư 20% so với ban đầu ) ta thu được sản phẩm AL2(SO4)3 và hơi nước
a )Tính khối lượng H2SO4 ban đầu đã dùng
b) tính khối lượng muối sinh ra
Al2O3 + 3H2SO4 -> Al2(SO4)3 + 3H2O
0.02 0.06 0.02
\(nAl2O3=\dfrac{2.04}{102}=0.02mol\)
a.mH2SO4 đã dùng\(=\dfrac{0.06\times98}{20\%}=29.4g\)
b.m muối sinh ra\(=0.02\times342=6.84g\)
Đúng 4
Bình luận (0)
BT2.Cho 10,2 g Al2O3vào dung dịch chứa 49g H2SO4 . Sau phản ứng hoàn toàn thu được Al2(SO4)3 và H2O . Tính khối lượng Al2(SO4)3 thu được
nAl = 10.2/102 = 0.1 mol
nH2SO4 = 0.5 mol
BT AL :
nAl2(SO4)3 = nAl2O3 = 0.1 mol
=> mAl2(SO4)3 = 34.2 g
Đúng 1
Bình luận (0)
Tính lượng muối nhôm sunfat tạo thành khí cho dung dịch chứa 490 gam axit H2SO4 10% tác dụng với 10,2 gam Al2O3. Tính khối lượng Al2(SO4)3 và nồng độ phần trăm các chất thu được trong dung dịch sau phản ứng?
n H2SO4=\(\dfrac{10\%.490}{2+32+16.4}=0,5mol\)
n Al2O3 =\(\dfrac{10,2}{27.2+16.3}=0,1mol\)
\(Al_2O_3+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2O\)
bđ 0,1............0,5
pư 0,1............0,3..................0,1
spu 0 ................0,2................0,1
=> sau pư gồm H2SO4 dư , Al2(S04)3 và H2O
m H2SO4 dư = \(0,2.\left(2+32+16.3\right)=19,6g\)
m Al2(SO4)3 = \(0,1\left(27.2+32.3+16.4.3\right)=34,2g\)
m dd = \(490+10,2=500,2g\)
% Al2(SO4)3 = \(\dfrac{34,2}{500,2}.100\sim6,84\%\)
% H2SO4 dư = \(\dfrac{19,6}{500,2}.100\sim3,92\%\)
Đúng 1
Bình luận (0)