Trong mỗi dung dịch sau đó có bao nhiêu ml ethylic alcohol?
a) 50 ml dung dịch ethylic alcohol 30oC.
b) 40 ml dung dịch ethylic alcohol 45oC.
Từ 600ml rượu ethylic 50° có thể pha được bao nhiêu ml rượu ethylic 25°
\(V_{C_2H_5OH}=\dfrac{600.50}{100}=300\left(ml\right)\\ \Rightarrow V_{ddC_2H_5OH\left(25^o\right)}=\dfrac{300.100}{25}=1200\left(ml\right)\)
Cho 150 ml alcohol 23 độ.
a. Tính thể tích, số mol, và khối lượng Ethanol có trong dung dịch alcohol. Cho khối lượng riêng của Ethanol là 0,8 ml.
b. Nếu ddootss cháy hoàn toàn lượng alcohol nói trên thì cần dùng bao nhiêu lít khí Oxygen (đkc)?
c. Nếu lên men lượng alcohol nói trên thì dung dịch acetic acid tạo thành có nồng độ là bao nhiêu? Biết hiệu suất phản ứng của quá trình lên men đạt 80%
Câu 5
A là dung dịch HCl. B là dung dịch Ba(OH)2.
Trộn 50 ml dung dịch A với 50 ml dung dịch B thu được dung dịch D có dư A. Để trung hòa hết lượng dư A trong D người ta phải dùng hết 50 ml dung dịch KOH 0,1M.
Trộn 50 ml dung dịch A với 150 ml dung dịch B thì thu được dung dịch E có dư B. Trung hòa hết lượng B dư trong E người ta phải dùng hết 350 ml dung dịch HNO3 0,1M. Tính nồng độ mol/lit của các dung dịch A, dung dịch B.
HELP ME!
Đặt nồng độ HCl trong dung dịch A là x
Đặt nồng độ Ba(OH)2 trong dung dịch B là y
- Khi trộn 50ml dung dịch A với 50ml dung dịch B thì HCl dư, ta có:
2HCl + Ba(OH)2 → BaCl2 + 2H2O (1)
0,1y← 0,05y mol
HCl + NaOH → NaCl + H2O (2)
0,005←0,005 mol
Ta có: 2.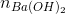 + nNaOH = nHCl
+ nNaOH = nHCl
0,1y + 0,005 = 0,05x
x– 2y = 0,1 (*)
- Khi trộn 50 ml dung dịch A với 150ml thì Ba(OH)2 dư, ta có:
2HCl + Ba(OH)2 → BaCl2 + 2H2O (3)
0,05x→0,025x mol
2HNO3 + Ba(OH)2 → Ba(NO3)2 + H2O (4)
0,035→ 0,0175 mol
Ta có: 2.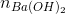 = (nHCl +
= (nHCl + 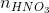 )
)
0,15y = 0,025x + 0,0175
x– 6y = - 0,7 (**)
Giải hệ pt:
x– 6y = -0,7
x– 2y = 0,1
=>x = 0,5; y= 0,2
=>CM của HCl = 0,5M
CM của Ba(OH)2 = 0,2M
phải lấy bao nhiêu ml dung dịch hno3 40% D= 1,25g/ml vào bao nhiêu ml dung dịch hno3 10% D=1,66g/ml để pha chế thành 400ml dung dịch hno3 15% D= 1,08g/ml
Bạn tham khảo tại đây nhé
http://hocdethi.blogspot.com/2014/01/tuyen-tap-bai-tap-hoa-hoc-10.html
Trộn 100 ml dung dịch HNO3 1M với 50 ml dung dịch Ba(OH)2 1M thu được dung dịch có pH bằng bao nhiêu?
A. 0
B. 1
C. 7
D. 14
Đáp án C
Do nH+= nOH-= 0,1 mol nên dung dịch thu được có pH=7
Hòa tan hoàn toàn 5 g CaCO3 trong 40 ml dung dịch HCl sau Phản ứng phải dùng hết 20 ml dung dịch NaOH Để trung hòa lượng axit dư Mặt khác 50 ml dung dịch HCl phản ứng vừa đủ với 150 ml dung dịch NaOH tính nồng độ mol của dung dịch HCl và NaOH
Cho 19.2 g Cu vào 500 ml dung dịch NaNO3, 1M, sau đó thêm 500 ml dung dịch HCl 2M được dung dịch A a. Cu có tan hết không? Tính thể tích NO bay ra ở đktc. b. Tính nồng độ mol các ion trong dung dịch A thu được sau phản ứng, c. Phải thêm bao nhiêu lít dung dịch NaOH 0,2 M để kết tủa hết Cu2+ chứa trong dung dịch A.
a. Phải thêm bao nhiêu gam H2O vào 300g dung dịch KOH 40% để được dung dịch KOH 15%.
b. Trộn 500 gam dung dịch NaOH 3% với 300 gam dung dịch NaOH 10% thì thu được dung dịch có nồng độ bao nhiêu %.
c. Cho 250 (ml) dung dịch NaCl 5M với x (ml) dung dịch NaCl 2M thu được dung dịch mới có nồng độ 3M. Tính x.
d. Phải thêm bao nhiêu gam H2O vào 400g dung dịch KOH 30% để được dung dịch KOH 20%.
e. Trộn 300 gam dung dịch NaOH 4% với 500 gam dung dịch NaOH 10% thì thu được dung dịch có nồng độ bao nhiêu %.
giải giúp mình nhé![]()
cần bao nhiêu ml dung dịch H2SO4 có khối lượng riêng là 1,64 g/ml pha với bao nhiêu ml dung dịch H2SO4 có khối lượng riêng là 1,28g/ml để thu được 600ml dung dịch có khối lượng riêng là 1,4g/ml
Trộn 50 ml dung dịch NaOH 0,12M với 50 ml dung dịch H2SO40,1M. Tính nồngđộ mol của các ion trong dung dịch thu được và pH của dung dịch đó.
\(n_{NaOH}=0,006\left(mol\right)\\ \Rightarrow n_{Na^+}=0,006\left(mol\right);n_{OH^-}=0,006\left(mol\right)\\ n_{H_2SO_4}=0,005\left(mol\right)\\ \Rightarrow n_{H^+}=0,01\left(mol\right);n_{SO_4^{2-}}=0,005\left(mol\right)\\ H^++OH^-\rightarrow H_2O\\ LTL:\dfrac{0,01}{1}>\dfrac{0,006}{1}\Rightarrow H^+dư\\ \left[H^+_{dư}\right]=\dfrac{0,01-0,006}{0,1}=0,04M\\ \left[Na^+\right]=\dfrac{0,006}{0,1}=0,06M\\ \left[SO_4^{2-}\right]=\dfrac{0,005}{0,1}=0,05M\)