Tìm các hệ số x,y trong phản ứng hóa học đã được cân bằng sau:
\(4Al + x{O_2} \to yA{l_2}{O_3}.\)
Lập phương trình hóa học của các phản ứng oxi hóa – khử sau, xác định vai trò của các chất tham gia phản ứng.
\(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\)
\(N{H_3} + B{r_2} \to {N_2} + HBr(2)\)
\(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\)
\(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\)
\(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5)
Phản ứng 1:

Phản ứng 2:

Phản ứng 3:

Phản ứng 4:

Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp:
a) \(HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + {H_2}O\)
b) \(KMn{O_4} + KN{O_2} + {H_2}S{O_4} \to MnS{O_4} + KN{O_3} + {K_2}S{O_4} + {H_2}O\)
c) \(F{e_3}{O_4} + HN{O_3} \to Fe{(N{O_3})_3} + NO \uparrow + {H_2}O\)
d) \({H_2}{C_2}{O_2} + KMn{O_4} + {H_2}S{O_4} \to C{O_2} \uparrow + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
Cho phản ứng hóa học:
A s 2 S 3 + H N O 3 + H 2 O → H 3 A s O 4 + H 2 S O 4 + N O
Sau khi cân bằng phương trình hóa học của phản ứng với hệ số tối giản, tổng hệ số của các chất tham gia phản ứng là
A. 43
B. 35
C. 31
D. 28
Chọn B
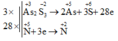
3As2S3 + 28HNO3 + 4H2O →6H3AsO4 + 9H2SO4 + 28NO
→ Tổng hệ số các chất tham gia phản ứng là: 3 + 28 + 4 = 35.
Cho phản ứng hóa học: FeS + H2SO4 đặc t o Fe2(SO4)3 + SO2↑ + H2O
Sau khi cân bằng phản ứng hoá học trên với hệ số của các chất là những số nguyên dương, tối giản thì tổng hệ số của H2SO4 và FeS là
A. 12
B. 10
C. 14
D. 16
Cho phản ứng hóa học sau:
FeO + HNO 3 → Fe NO 3 3 + NO + H 2 O
Tổng hệ số cân bằng (là các số nguyên và tối giản) của phản ứng hóa học đó là
A. 15.
B. 25.
C. 24.
D. 22.
Cho phản ứng hóa học sau: Fe2O3 + H2SO4 --> Fe2(SO4)3 + H2O Tổng hệ số cân bằng các chất trong phản ứng trên là: *
A. 7
B. 8
C. 9
D. 10
Chọn hệ số thích hợp để cân bằng phản ứng hóa học sau:
S O 2 + O 2 − t o → S O 3
Cho cân bằng hóa học :
![]()
Biết phản ứng thuận là phản ứng thu nhiệt. Tác động nào sau đây vào hệ cân bằng để cân bằng đã cho chuyển dịch theo chiều thuận?
A. Giảm nhiệt độ
B. Tăng áp suất
C. Tăng nồng đột khí CO2
D. Tăng nhiệt độ
Chọn D
Khi tăng nhiệt độ, cân bằng hóa học chuyển dịch theo chiều thu nhiệt, tức là chiều thuận.
Khi tăng nồng độ của khí CO2, cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm nồng độ của CO2, tức là chiều nghịch.
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất hay chiều làm giảm số phân tử khí, tức là chiều nghịch.
Chọn hệ số thích hợp để cân bằng phản ứng hóa học sau:
A l ( O H ) 3 − t o → A l 2 O 3 + H 2 O
Cho phản ứng hóa học sau: F e S 2 + O 2 → F e 2 O 3 + S O 2
Khi cân bằng phương trình phản ứng với hệ số các chất là các số nguyên tối giản, hệ số của O2 là
A. 4
B. 6
C. 9
D. 11
Chọn D
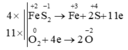
4 F e S 2 + 11 O 2 → 2 F e 2 O 3 + 8 S O 2