1. Tính số mol của các chất sau
112 ml NO2 ; 224 ml CO2 ; 336 ml N2O ; 672 ml Cl2 ; 8,96 L O2 ; 115 ml SO2 ; 225 ml H2S
1 tính thể tích khí của các hỗn hợp chất khí sau ở đktc và tính điều kiện thường:
a )0,1 mol CO2 ; 0,2 mol NO2 ; 0,02 mol SO2 và 0,03 mol N2
b) 0,04 mol N2O; 0,015 mol NH3; 0,06 mol H2 ;0,08 mol H2S
2 tính thể tích khí ở đktc của
a )0,5 mol phân tử khí H2 ;0,8 mol phân tử khí O2
B )2 mol CO2 ; 3 mol khí CH4
C) 0,9 m khí N2; 1,5 mol khí H2
1.
\(a.\)
\(V_{hh}=\left(0.1+0.2+0.02+0.03\right)\cdot24=8.4\left(l\right)\)
\(b.\)
\(V_{hh}=\left(0.04+0.015+0.06+0.08\right)\cdot24=4.68\left(l\right)\)
\(2.\)
\(a.\)
\(V_{H_2}=0.5\cdot22.4=11.2\left(l\right)\)
\(V_{O_2}=0.8\cdot22.4=17.92\left(l\right)\)
\(b.\)
\(V_{CO_2}=2\cdot22.4=44.8\left(l\right)\)
\(V_{CH_4}=3\cdot22.4=67.2\left(l\right)\)
\(c.\)
\(V_{N_2}=0.9\cdot22.4=20.16\left(l\right)\)
\(V_{H_2}=1.5\cdot22.4=33.6\left(l\right)\)
Bài 1.Tính nồng độ mol của 850 ml dung dịch có hòa tan 20g KNO3.
Bài 2.Tỉnh nồng độ mol của 0,5 mol KCl trong 750 ml dung dịch
Bài 3.Hãy tính số mol và số gam chất tan có trong 500 ml dung dịch KNO; 2M
Bài 4.Hãy tính nổng độ phần trăm của 20 g KCl trong 600 g dung dịch
Bài 1:
\(n_{KNO_3}=\dfrac{20}{101}=0,198\left(mol\right)\)
\(C_M=\dfrac{n}{V}=\dfrac{0,198}{0,85}=0,233M\)
Bài 2:
\(C_M=\dfrac{n}{V}=\dfrac{0,5}{0,75}=0,66M\)
Bài 3:
\(n_{KNO_3}=2.0,5=1\left(mol\right)\)
\(m_{KNO_3}=1.101=101\left(g\right)\)
Bài 4:
\(C\%=\dfrac{20}{600}.100=3,33\%\)
Bài 1:
\(n_{KNO_3}=\dfrac{20}{101}=0,198\left(mol\right)\)
\(C_{M_{ddKNO_3}}=\dfrac{0,198}{0,85}\approx0,23M\)
Bài 2:
\(C_{M_{ddKCl}}=\dfrac{0,5}{0,75}\approx0,667M\)
Bài 3:
\(n_{KNO_3}=0,5.2=1\left(mol\right)\Rightarrow m_{KNO_3}=1.101=101\left(g\right)\)
Bài 4:
\(C\%_{ddKCl}=\dfrac{20.100\%}{600}=3,333\%\)
Nhiệt phân 14,8 g Mg(NO3)2, phản ứng xảy ra theo sơ đồ sau:
Mg(NO3)2 ---> MgO + NO2 + O2
a) Cân bằng PTHH của phản ứng trên.
b) Tính số mol các chất tạo thành.
`#3107.101107`
`a)`
\(2\text{Mg}\left(\text{NO}_3\right)_2\rightarrow2\text{MgO}+4\text{NO}_2+\text{O}_2\)
`b)`
n của \(\text{Mg}\left(\text{NO}_3\right)_2\) trong phản ứng là:
\(\text{n}_{\text{Mg}\left(\text{NO}_3\right)_2}=\dfrac{\text{m}}{\text{M}}=\dfrac{14,8}{24+\left(14+16\cdot3\right)\cdot2}=\dfrac{14,8}{148}=0,1\left(\text{mol}\right)\)
Theo PT: 2 : 2 : 4 : 1 (mol)
`=>`\(\text{n}_{\text{Mg}\left(\text{NO}_3\right)_2}=\text{n}_{\text{MgO}}=2\text{n}_{\text{NO}_2}=\dfrac{1}{2}\text{n}_{\text{O}_2}\)
`=>` \(\text{n}_{\text{NO}_2}=\dfrac{0,1}{2}=0,05\left(\text{mol}\right)\) ; \(\text{n}_{\text{O}_2}=0,1\cdot2=0,2\left(\text{mol}\right).\)
Hỗn hợp rắn X gồm ba chất có số mol bằng nhau trong số các chất sau: (1) Fe; (2) FeCO3; (3) Fe2O3; (4) Fe(OH)2. Lấy 1 mol X tác dụng với dung dịch HNO3 đặc nóng (dùng dư) thu được 1 mol khí. Biết khí NO2 là sản phẩm khử duy nhất của N+5. Hỗn hợp X gồm:
A.(1),(2),(3).
B. (2),(3),(4).
C. (1),(3),(4).
D. (1),(2),(4).
Hỗn hợp rắn X gồm ba chất có số mol bằng nhau trong số các chất sau: (1) Fe, (2) FeCO3, (3) Fe2O3, (4) Fe(OH)2. Lấy 1 mol X tác dụng với dung dịch HNO3 đặc, nóng (dùng dư), thu được 1 mol khí. Biết khí NO2 là sản phẩm khử duy nhất của N+5. Hỗn hợp X gồm
A. (1), (2), (3.)
B. (2), (3), (4).
C. (1), (3), (4).
D. (1), (2), (4).
Cho một bình kín dung dịch không đổi 3,4 lít chứa 40 ml nước (D = 1g/ml), phần không khí gồm N2 và O2 với tỉ lệ mol 4:1. Bơm hết 896 ml hỗn hợp khí B và NO2 và NO có tỉ khối hơi so với H2 bằng 19 vào bình và lắc kĩ bình tới khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Biết các khi đo ở đktc. Tính nồng độ phần trăm chất tan có trong dung dịch X
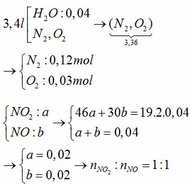
Tỉ lệ mol của 2 khí NO2 và NO là 1:1, khí O2 không đủ nên giả sử mol pứ đều là: x (mol)
2NO2 + ½ O2 + H2O → 2HNO3
x→ 0,25x x
2NO + 1,5O2 + H2O → 2HNO3
x → 0,75x x
pứ: x 2x
nO2 = 0,03 => x = 0,03
=> nHNO3 = 0,06
mbình sau pứ = N2 + mO2 + mH2O+ mNO2 + mNO = 28 . 0,12 + 32 . 0,03 + 40 + 19 . 2 . 0,04 = 45,84g
=> %HNO3 = 8,246%
Hỗn hợp X gồm ba chất có cùng số mol trong số các chất sau: (1) Fe, (2) FeCO3, (3) FeO, (4) Fe(OH)3. Cho a mol X tác dụng với HNO3 (đặc, nóng, dư), sau phản ứng còn lại a mol khí. Biết NO2 là sản phẩm khử duy nhất của N+5. Hỗn hợp X gồm
A. (1), (2), (4).
B. (1), (3), (4).
C. (2), (3), (4).
D. (1), (2), (3).
Cho 24 gam fe2 o3 vào 200 ml dung dịch h2so4 2,5M a, hãy tính số mol các chất đã cho trước phản ứng B, tính số mol chất còn dư ( nếu có) sau phản ứng C, tính nồng độ mol của dung dịch sau phản ứng biết thể tích dung dịch thay đổi không đáng kể
a) $n_{Fe_2O_3} = \dfrac{24}{160} = 0,15(mol)$
$n_{H_2SO_4} =0,2.2,5 = 0,5(mol)$
b)
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Vì :
$n_{Fe_2O_3} : 1 < n_{H_2SO_4} : 3$ nên $H_2SO_4$ dư
$n_{H_2SO_4\ pư} = 3n_{Fe_2O_3} = 0,45(mol)$
$n_{H_2SO_4\ dư} = 0,5 - 0,45 = 0,05(mol)$
c)
$n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = 0,15(mol)$
$C_{M_{Fe_2(SO_4)_3}} = \dfrac{0,15}{0,2} = 0,75M$
$C_{M_{H_2SO_4}} = \dfrac{0,05}{0,2} = 0,25M$
1 Tính số mol của H2SO4 trong 100 ml dd H2SO4 49% .
Sau đó tính nồng độ mol của H2SO4
2 Tính nồng độ mol của các dd sau
a 3,65g HCl trong 200 ml dd
b 0.2 mol H2SO4 trong 100 dd
1 thiếu m dd H2SO4 hoặc D nhé
2
\(a\) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5M\)
\(b\) \(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)