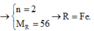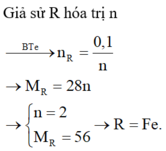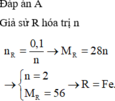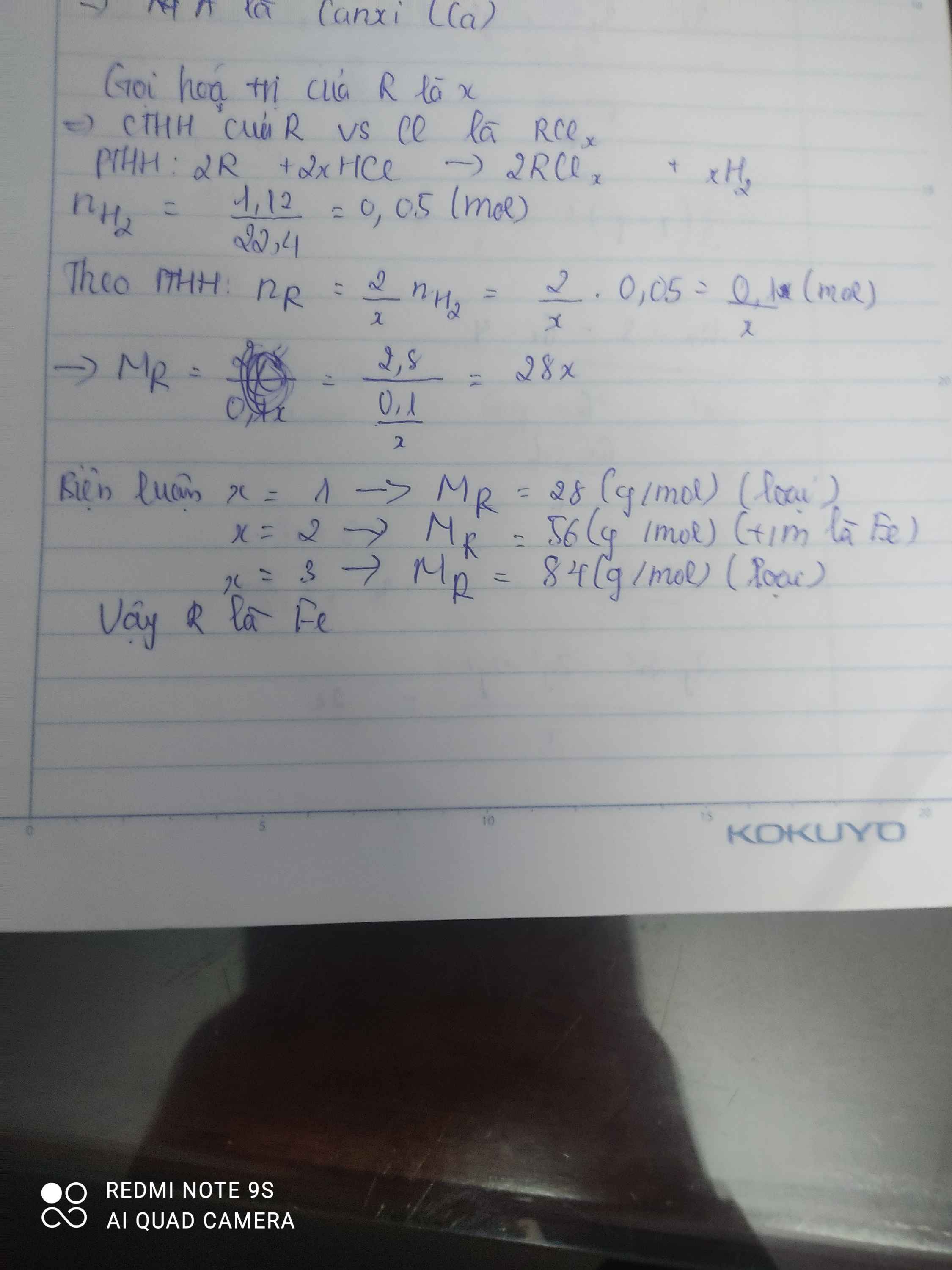Hoà tan hoàn toàn 32,5 g một kim loại M ( hoá trị 2 ) bằng dung dịch FeSO4 loãng được 28gam sắt . Kim loại M là : A. Zn B. Al C.Mg D.Ca

Những câu hỏi liên quan
âu 33:Hoà tan hoàn toàn 3,2 g một kim loại X (hoá trị II) bằng dung dịch H2SO4loãng thu được , 2 lít khí H2ở đktc. Vậy X là kim loại nào sau đây:A. FeB. MgC. CaD. Zn
Hoà tan hoàn toàn 2,8 gam một kim loại R chưa rõ hoá trị bằng dung dịch HCl loãng dư, sau phản ứng thu được 1,12 lít H2 (đktc). Kim loại R là:
A. Fe.
B. Cu.
C. Zn.
D. Al.
Hoà tan hoàn toàn 2,8 gam một kim loại R chưa rõ hoá trị bằng dung dịch HCl loãng dư, sau phản ứng thu được 1,12 lít H2 (đktc). Kim loại R là:
A. Fe
B. Cu
C. Zn
D. Al
Hoà tan hoàn toàn 2,8 gam một kim loại R chưa rõ hoá trị bằng dung dịch HCl loãng dư, sau phản ứng thu được 1,12 lít H2 (đktc). Kim loại R là
A. Fe
B. Cu.
C. Zn.
D. Al.
Hoà tan hoàn toàn 2,8 gam một kim loại R chưa rõ hoá trị bằng dung dịch HCl loãng dư, sau phản ứng thu được 1,12 lít H2 (đktc). Kim loại R là
Hoà tan hết 3,6g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36lít H2 (đktc). Kim loại là
1.Ca.
2.Mg.
3.Zn.
4.Fe.
Gọi kim loại là M
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(PTHH:M+H_2SO_4--->MSO_4+H_2\)
Theo PT: \(n_M=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{3,6}{0,15}=24\left(g\right)\)
Vậy M là magie (Mg)
Chọn 2
Đúng 2
Bình luận (0)
Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H 2 S O 4 loãng được 3,36 lít H 2 (đktc). Kim loại là
A. Zn
B. Mg
C. Fe
D. Ca
Hoà tan hoàn toàn a(g) hỗn hợp hai kim loại:A(hoá trị II) và B hoá trị(III) bằng dung dịch HCl.Sau phả ứng thu đc 76,25g muối và 19,04lít khí H2(đktc)a.Tính giá trị ab.Nếu biết kim loại B là Al và số mol bằng 5 lần số mol của A thì A là kim loại nào c.Cho toàn bộ H2 ở trên đi qua ống thuỷ tinh chứa 16g bột CuO đun nóng,sau phản ứng thu đc 13,6g chất rắn.Tính hiệu suất phản ứng
Đọc tiếp
Hoà tan hoàn toàn a(g) hỗn hợp hai kim loại:A(hoá trị II) và B hoá trị(III) bằng dung dịch HCl.Sau phả ứng thu đc 76,25g muối và 19,04lít khí H2(đktc)
a.Tính giá trị a
b.Nếu biết kim loại B là Al và số mol bằng 5 lần số mol của A thì A là kim loại nào
c.Cho toàn bộ H2 ở trên đi qua ống thuỷ tinh chứa 16g bột CuO đun nóng,sau phản ứng thu đc 13,6g chất rắn.Tính hiệu suất phản ứng
a, \(n_{H_2}=\dfrac{19,04}{22,4}=0,85\left(mol\right)\)
=> mH2 = 0,85.2 = 1,7 (g)
PTHH:
A + 2HCl ---> ACl2 + H2
2B + 6HCl ---> 2BCl3 + 3H2
Theo pthh: nHCl = 2nH2 = 2.0,85 = 1,7 (mol)
-> mHCl = 1,7.36,5 = 62,05 (g)
ĐTBTKL:
mkl (A. B) + mHCl = mmuối (ACl2, BCl3) + mH2
=> a = mkl (A, B) = 76,25 + 1,7 - 62,05 = 15,9 (g)
b, Gọi nA = a (mol)
=> nAl = 5a (mol)
Theo pthh: nH2 = nA + \(\dfrac{3}{2}n_{Al}\) = a + \(\dfrac{3}{2}.5a\) = 8,5a
=> 8,5a = 0,85
=> a = 0,1 (mol)
=> nAl = 0,1.5 = 0,5 (mol)
=> mAl = 0,5.27 = 13,5 (g)
=> mA = 15,9 - 13,5 = 2,4 (g)
=> MA = \(\dfrac{2,4}{0,1}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
c, nCuO = \(\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: CuO + H2 ---to---> Cu + H2O
LTL: 0,2 < 0,85 => H2 dư
Gọi nCuO (pư) = a (mol)
=> nCu (sinh ra) = a (mol)
Ta có: mchất rắn (sau pư) = 80(0,2 - a) + 64a = 13,6
=> a = 0,15 (mol)
=> H = \(\dfrac{0,15}{0,2}=75\%\)
Đúng 1
Bình luận (0)
Hoà tan hoàn toàn 16 gam oxit kim loại M có hóa trị II cần dùng 200ml dung dịch H2SO4 loãng 1M. Xác định kim loại trong oxit trên?
A. Cu B. Mg C. Zn D. Ca
\(n_{H_2SO_4}=1\cdot0,2=0,2\left(mol\right)\\ PTHH:MO+H_2SO_4\rightarrow MSO_4+H_2O\\ \Rightarrow n_{MO}=n_{H_2SO_4}=0,2\left(mol\right)\\ \Rightarrow M_{MO}=\dfrac{16}{0,2}=80\left(g/mol\right)\\ \Rightarrow PTK_M=80-16=64\left(đvC\right)\)
Do đó M là Cu
Vậy chọn A
Đúng 3
Bình luận (0)