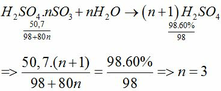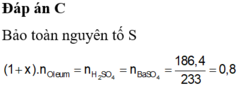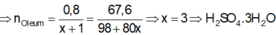Hòa tan 6,76 gam oleum vào nước thì thu được 200ml dung dịch H2SO4 0,4M. Công thức của oleum

Những câu hỏi liên quan
Hòa tan 6,76 gam oleum vào nước dung dịch Y, để trung hòa dung dịch Y cần 160 ml dung dịch NaOH 1M. Công thức phân tử tử oleum là A.
H
2
SO
4
.
nSO
3
B.
H
2
SO
4
.
5
SO
3
C.
H
2
SO...
Đọc tiếp
Hòa tan 6,76 gam oleum vào nước dung dịch Y, để trung hòa dung dịch Y cần 160 ml dung dịch NaOH 1M. Công thức phân tử tử oleum là
A. H 2 SO 4 . nSO 3
B. H 2 SO 4 . 5 SO 3
C. H 2 SO 4 . 3 SO 3
D. H 2 SO 4 . 4 SO 3
Đáp án C
Số mol NaOH là: n NaOH = 0 , 16 . 1 = 0 , 16 mol
Đặt công thức của oleum là H 2 SO 4 . nSO 3
Oleum tác dụng với H 2 O :
H 2 SO 4 . nSO 3 + nH 2 O → ( n + 1 ) H 2 SO 4 ( 1 )
Dung dịch Y là dung dịch H 2 SO 4 . Trung hòa dung dịch Y bằng dung dịch NaOH:
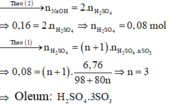
Đúng 0
Bình luận (0)
Hòa tan 50,7 gam oleum có công thức H2SO4.nSO3 vào nước, thu được 98 gam dung dịch H2SO4 60%. Xác định giá trị n. H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau: H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
Đọc tiếp
Hòa tan 50,7 gam oleum có công thức H2SO4.nSO3 vào nước, thu được 98 gam dung dịch H2SO4 60%. Xác định giá trị n.
H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau:
H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
Biết oleum có công thức là H2SO4.nSO3. Hòa tan 6,76g oleum này vào nước thành 200ml dung dịch H2SO4. Biết rằng 10ml dung dịch này trung hòa vừa hết 16ml dung dịch NaOH 0,5M. Xác định n.
Cho 6,76 gam Oleum H2SO4.nSO3 vào nước thành 200ml dung dịch. Lấy 10ml dung dịch này trung hòa vừa đủ với 16ml dung dịch NaOH 0,5M. Giá trị của n là: A. 2 B. 1 C. 4 D. 3
Đọc tiếp
Cho 6,76 gam Oleum H2SO4.nSO3 vào nước thành 200ml dung dịch. Lấy 10ml dung dịch này trung hòa vừa đủ với 16ml dung dịch NaOH 0,5M. Giá trị của n là:
A. 2
B. 1
C. 4
D. 3
axit H2SO4 100% hấp thụ SO3 tạo ra oleum theo phương trình H2SO4 + SO3 -> H2SO4.nSO3 . Hòa tan 6,76 gam gam oleum vào nước thành 200 ml dung dịch H2SO4 . 10 ml dung dịch trung hòa vừa hết 16 ml dung dịch NaOH 0,5 M a- tính n b- tính hàm lượng % SO3 trong oleum c- cần có bao nhiêu gam oleum có hàm lượng SO3 như trên để pha vào 100 ml dung dịch H2SO4 40% , d= 1,31 g/ml để tạo ra oleum có hàm lượng SO3 là 10%.
H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé
Đúng 1
Bình luận (0)
hòa tan 6,76 gam oleum vào nước thành 200ml dd H2SO4. 10 ml dd đó trung hòa vừa hết 16 ml dd NaOH 0.5 M. xđ công thức oleum
số mol NaOH=0,008, suy ra số mol H2so4 trong pứ là 0,004
xét trong 200ml thì số mol h2so4 pứ vs kiềm là 0,08 mol.
PT: h2so4.nSo3+nH2O=(n+1)h2so4
0,08\(n+1)mol 0,08mol
suy ra: 0,08\(n+1) * (98+80n)=6,76
vây n=3. oleum la h2so4.3so3
Đúng 0
Bình luận (0)
Hoà tan 67,6 gam oleum H2SO4.xSO3 vào nước thu được dung dịch X. Sau đó cho từ từ một lượng dư BaCl2 vào X thấy có 186,4 gam kết tủa trắng. Công thức của oleum là: A. H2SO4.SO3 B. H2SO4.2SO3 C. H2SO4.3SO3 D. H2SO4.4SO3
Đọc tiếp
Hoà tan 67,6 gam oleum H2SO4.xSO3 vào nước thu được dung dịch X. Sau đó cho từ từ một lượng dư BaCl2 vào X thấy có 186,4 gam kết tủa trắng. Công thức của oleum là:
A. H2SO4.SO3
B. H2SO4.2SO3
C. H2SO4.3SO3
D. H2SO4.4SO3
Cho 4,98 gam oleum hòa tan vào nước thu được dung dịch A. Để trung hòa hết A cần 600ml Ba(OH)2 0,1M thu được m gam kết tủa.
a, Xác định công thức của oleum
b, Tính khối lượng kết tủa ?
c, Tính khối lượng oleum cần để hòa tan vào 500ml nước tạo thành dung dịch H2SO4 20%
H2SO4.nSO3+H2O --> (n+1)H2SO4
H2SO4+Ba(OH)2 -> BaSO4 + 2H2O
a.nBaSO4= 0,06 mol
=> nH2SO4=0,06 mol
ta có PT
\(\dfrac{4,98}{98+80n}=\dfrac{0,06}{n+1}\)
=> n=5. CT H2SO4.5SO3
b. mBaSO4= 0,06*233=13,98(g)
c)a mol H2SO4 5SO3
=> mol SO3 = 5a và H2SO4 a mol
SO3 + H2O --> H2SO4
5a--------5a----------5a
=> mol H2SO4 6a mol => mH2SO4 = 588a
=>
m dd sau hòa tan = mH2O + mA = 500 + 498a
Bảo toàn m H2SO4: 588a = 0,2(500 + 498a) => a => mA = 498a
Đúng 3
Bình luận (1)
Hoà tan 51,6 gam oleum H2SO4.xSO3 vào nước thu được dung dịch X. Sau đó cho từ từ một lượng dư BaCl2 vào X thấy có 139,8 gam kết tủa trắng. Tìm công thức oleum?
Bảo toàn S:
\(\left(1+x\right)n_{oleum}=n_{H_2SO_4}=n_{BaSO_4}\)
\(n_{BaSO_4}=\dfrac{139,8}{233}=0,6mol\)
\(\Rightarrow n_{oleum}=\dfrac{0,6}{1+x}=\dfrac{51,6}{98+80x}\)
\(\Rightarrow x=2\)
Vậy oleum là \(H_2SO_4.3SO_3\)
Đúng 2
Bình luận (0)