lam pp bao toan e giúp ạ
cần ? g đồng để khử hoàn toàn lượng bạc có trong 85ml dd AgNO3 0,15M ?
Cần bao nhiêu gam đồng để khử hoàn toàn lượn ion bạc có trong 85ml dung dịch AgNO3 0,15M?
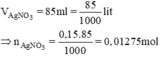
Phương trình hóa học của phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Theo pt:
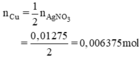
mCu tham gia phản ứng: 0,006375 × 64 = 0,408 g.
BT?
Cần bao nhiêu gam đồng để khử hoàn toàn lượng bạc có trong 85 ml dung dịch AgNO3 0,15M?
không nhầm thì kết quả là 4,08g nà pạn
HD:
Cu + 2AgNO3 \(\rightarrow\) Cu(NO3)2 + 2Ag
Số mol Cu = 1/2 số mol AgNO3 = 0,15.0,085/2 = 0,006375 mol.
Khối lượng Cu = 0,006375.64 = 0.408 g.
cho 100g đ Na2SO4 2,84% tác dụng hoàn toàn với dd Ba(NO3)2 2,088%
a. viết phương trình hóa học
b. tính khối lượng dd Ba(NO3)2
c. Tính phần trăm các chất có trong dd sau phản ứng
Giúp em ạ
cần
\(m_{ct}=\dfrac{2,84.100}{100}=2,84\left(g\right)\)
\(n_{Na2SO4}=\dfrac{2,84}{142}=0,02\left(mol\right)\)
a) Pt ; \(Na_2SO_4+Ba\left(NO_3\right)_2\rightarrow2NaNO_3+BaSO_4|\)
1 1 2 1
0,02 0,02 0,04 0,02
b) \(n_{Ba\left(NO3\right)2}=\dfrac{0,02.1}{1}=0,02\left(mol\right)\)
\(m_{Ba\left(NO3\right)2}=0,02.261=5,22\left(g\right)\)
\(m_{ddBa\left(NO3\right)2}=\dfrac{5,22.100}{2,088}=250\left(g\right)\)
c) \(n_{NaNO3}=\dfrac{0,02.2}{1}=0,04\left(mol\right)\)
⇒ \(m_{NaNO3}=0,04.85=3,4\left(g\right)\)
\(n_{BaSO4}=\dfrac{0,04.1}{2}=0,02\left(mol\right)\)
⇒ \(m_{BaSO4}=0,02.233=4,66\left(g\right)\)
\(m_{ddspu}=100+250-4,66=345,34\left(g\right)\)
\(C_{NaNO3}=\dfrac{3,4.100}{345,34}=0,98\)0/0
Chúc bạn học tốt
a, \(n_{Na_2SO_4}=100.2,84\%=2,84\left(g\right)\Rightarrow n_{Na_2SO_4}=\dfrac{2,84}{142}=0,02\left(mol\right)\)
PTHH: Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4
Mol: 0,02 0,02 0,04 0,02
b,\(m_{ddBa\left(NO_3\right)_2}=\dfrac{0,02.261.100}{2,088}=250\left(g\right)\)
c, mdd sau pứ = 100+250-0,02.233 = 345,34 (g)
\(C\%_{ddNaNO_3}=\dfrac{0,04.85.100\%}{345,34}=0,98\%\)
Giúp e bài này với e đang cần gấp ạ! Em xin cảm ơn! Ngâm 1 lá đồng trong 1000ml dd AgNo3, đến khi phản ứng hoàn toàn. Lấy lá đồng ra, làm khô thì thấy KL lá đồng tăng thêm 15,2g. Hãy xác định nồng độ mol của dd AgNo3
Bài 1: ngâm một lá đồng trong 500ml dd AgNO3 đến khi phản ứng hoàn toàn. Lấy lá đồng ra làm khô , cân thì lấy khối lượng lá đồng tăng thêm 15,2g . Hãy xác định nồng độ của mol của dd bạc nitrat.
Bài 2: cho 78g một kim loại A tác dụng với khí clo dư tạo thành 149g muối. Hãy xác định kim loại A, biết rằng A có hóa trị 1
Bài 3: viết các PTHH :
a, điều chế Zn từ ZnSO4
b, điều chế MgSO4 từ mỗi chất sau: Mg, MgCl2, MgO, MgCO3
các hóa chất cần thiết coi như đủ
Bài 1 :
Pt : \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag|\)
1 2 1 2
x 0,2 2x
Gọi x là số mol của Cu
Vì khối lượng của đồng tăng so với ban đầu nên ta có phương trình :
\(m_{Ag}-m_{Cu}=15,2\left(g\right)\)
\(108.2x-64.x=15,2\)
\(216x-64x=15,2\)
\(152x=15,2\)
⇒ \(x=\dfrac{15,2}{152}=0,1\)
\(n_{AgNO3}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
500ml = 0,5l
\(C_{M_{ddAgNO3}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Chúc bạn học tốt
Hòa tan hoàn toàn 3g hỗn hợp E gồm đồng và bạc vào 500ml dd H2SO4 (d = 1,84 g/ml) thu đc dd F trong đó lượng H2SO4 còn dư bằng 92,4% luoiwngj ban đầu. Đổ từ từ dd F vào 107,24 ml nước cất thì vừa đủ tạo thành 200g dd G
1. XĐ thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp E
2. Tính nồng đọ C % các chất tan trong dd G và của dd H2SO4 ban đầu. Cho biết khối lượng riêng của nước bằng 1g/ml
Để tráng bạc một chiếc gương soi, người ta phải đun nóng dung dịch chứa 36 g glucozơ với lượng vừa đủ dung dịch AgNO 3 trong amoniac. Khối lượng bạc đã sinh ra và bám vào mặt kính của gương và khối lượng AgNO 3 cần dùng lần lượt là (biết các phản ứng xảy ra hoàn toàn):
A. 68 gam; 43,2 gam
B. 21,6 gam; 68 gam
C. 43,2 gam; 68 gam
D. 43,2 gam; 34 gam
Bài 1: ngâm một lá đồng 500ml dd AgNO3 đến khi phản ứng hoàn toàn. lấy lá đồng ra làm khô, cân thì thấy khối lượng lá đồng tăng thêm 15,2g. Hãy xác định nồng độ mol của dd bạc nitrat...
Bài 2: cho 78g một kim loại A tác dụng với khí clo dư tạo thành 149g muối . Hãy xác định kim loại A có hóa trị 1.
Bài 3: viết các pthh
a, điều chế Zn từ ZnSO4
b, điều chế MgSO4 từ mỗi chất sau : Mg, MgCl2, MgO, MgCO3
các chất cần thiết coi như đủ
Bài 1:
\(PTHH:Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\\ \Rightarrow n_{Ag}=2n_{Cu}\\ m_{tăng}=m_{Ag}-m_{Cu}=15,2\left(g\right)\\ \Rightarrow108n_{Ag}-64n_{Cu}=15,2\\ \Rightarrow216n_{Cu}-64n_{Cu}=15,2\\ \Rightarrow n_{Cu}=0,1\left(mol\right)\\ \Rightarrow n_{AgNO_3}=0,2\left(mol\right)\\ \Rightarrow C_{M_{AgNO_3}}=\dfrac{0,2}{0,5}=0,4M\)
Bài 2:
\(n_A=\dfrac{78}{M_A}\left(mol\right);n_{ACl}=\dfrac{149}{M_A+35,5}\left(mol\right)\\ PTHH:2A+Cl_2\rightarrow2ACl\\ \Rightarrow n_A=n_{ACl}\Rightarrow\dfrac{78}{M_A}=\dfrac{149}{M_A+35,5}\\ \Rightarrow78M_A+2769=149M_A\\ \Rightarrow71M_A=2769\\ \Rightarrow M_A=39\\ \Rightarrow A\text{ là kali }\left(K\right)\)
Bài 3:
\(a,2Al+3ZnSO_4\rightarrow Al_2\left(SO_4\right)_3+3Zn\\ b,Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ MgO+H_2SO_4\rightarrow MgSO_4+H_2O\\ MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\uparrow\)
Cho mg KOH tác dụng hoàn toàn với 200 ml dd HCl 2M.
a. Tính m.
b. Cho dd kali clorua KCl trên tác dụng với dd bạc nitrat AgNO3 dư. Tính khối lượng kết tủa thu được.
c. Lọc bỏ kết tủa cô cạn dd thu được bao nhiêu gam muối khan.
PTHH: \(KOH+HCl\rightarrow KCl+H_2O\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\downarrow\)
Ta có: \(n_{HCl}=0,2\cdot2=0,4\left(mol\right)=n_{KOH}=n_{KNO_3}=n_{AgCl}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{KOH}=0,1\cdot56=5,6\left(g\right)\\m_{AgCl}=0,1\cdot143,5=14,35\left(g\right)\\m_{KNO_3}=0,1\cdot101=10,1\left(g\right)\end{matrix}\right.\)