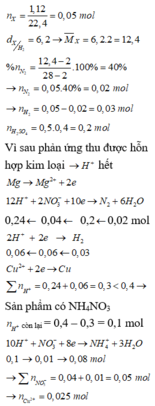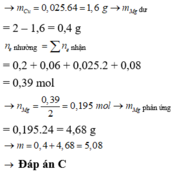hòa tan hoàn toàn một hỗn hợp có chứ 13,8 gam kim loại natri và 13,7 gam kim loại bari vào cốc chứa 500ml nước .Sau pảnh ứng thu được dung dịch chứa Natri Hidroxt, Bari hidroxit và khí hidro
a. viết pt phản ứng hóa học
b.tính thể tích khí hidro sinh ra
c. nếu cho mẩu giấy quỳ tím vào dung dịch thu được sau phản ứng thì giấy quỳ tím hóa màu gì?