Xác định các chất tương ứng vs các chữ cái. Viết PTHH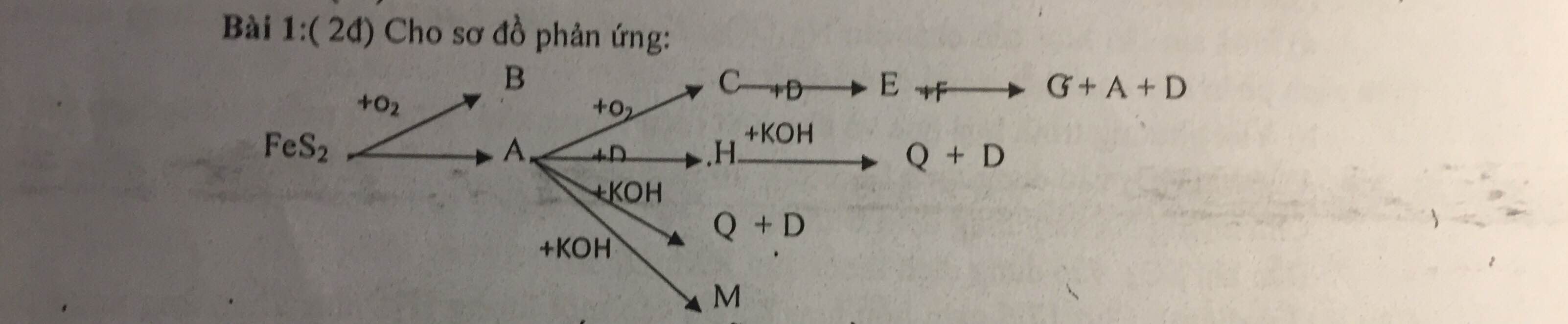

Những câu hỏi liên quan
Hãy xác định các chất để thỏa mãn sơ đồ phản ứng sau :( biết mỗi chữ cái khác nhau tương ứng với một chất khác nhau ) . Viết phương trình hóa học và ghi rõ điều kiện phản ứng 1. A+O2--B+D 2.E+O2--B 3.D--O2+G4.M+G--Cu+D 5.Fe2O3+G--L+D 6.L+O2--Q7.Q+G--L+D 8.L+HCl--X+G
Đọc tiếp
Hãy xác định các chất để thỏa mãn sơ đồ phản ứng sau :( biết mỗi chữ cái khác nhau tương ứng với một chất khác nhau ) . Viết phương trình hóa học và ghi rõ điều kiện phản ứng
1. A+O2-->B+D 2.E+O2-->B 3.D-->O2+G
4.M+G--Cu+D 5.Fe2O3+G-->L+D 6.L+O2-->Q
7.Q+G-->L+D 8.L+HCl-->X+G
1. CH4 + 2O2 -> (t°) CO2 + 2H2O
2. C + O2 -> (t°) CO2
3. 2H2O -> (điện phân) 2H2 + O2
4. CuO + H2 -> (t°) Cu + H2O
5. Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
6. 3Fe + 2O2 -> (t°) Fe3O4
7. Fe3O4 + 4H2 -> (t°) 3Fe + 4H2O
8. Fe + 2HCl -> FeCl2 + H2
Đúng 5
Bình luận (0)
C2. Xác định các chất tương ứng với các chữ cái mathrm{A}, mathrm{B}, mathrm{D}, mathrm{E}, mathrm{F}, mathrm{G}, mathrm{H}, mathrm{I}, mathrm{K}, mathrm{L} , mathrm{M}, mathrm{N}, mathrm{P}, mathrm{Q} và hoàn thành các phương trình phản ứng.(1) mathrm{FeS}_{2}+mathrm{O}_{2} rightarrow mathrm{A}+mathrm{B} uparrow (5) mathrm{H}+mathrm{M} rightarrow mathrm{N} (2) mathrm{B}+mathrm{D} rightarrow mathrm{E} downarrow+mathrm{F} (6) mathrm{N}+mathrm{I} rightarrow mathrm{P} downarrow+mathrm{L} (v...
Đọc tiếp
C2. Xác định các chất tương ứng với các chữ cái \( \mathrm{A}, \mathrm{B}, \mathrm{D}, \mathrm{E}, \mathrm{F}, \mathrm{G}, \mathrm{H}, \mathrm{I}, \mathrm{K}, \mathrm{L} \), \( \mathrm{M}, \mathrm{N}, \mathrm{P}, \mathrm{Q} \) và hoàn thành các phương trình phản ứng.
(1) \( \mathrm{FeS}_{2}+\mathrm{O}_{2} \rightarrow \mathrm{A}+\mathrm{B} \uparrow \)
(5) \( \mathrm{H}+\mathrm{M} \rightarrow \mathrm{N} \)
(2) \( \mathrm{B}+\mathrm{D} \rightarrow \mathrm{E} \downarrow+\mathrm{F} \)
(6) \( \mathrm{N}+\mathrm{I} \rightarrow \mathrm{P} \downarrow+\mathrm{L} \) (vàng)
(7) \( \mathrm{P}+\mathrm{F}+\mathrm{Q} \rightarrow \mathrm{K} \)
(3) \( \mathrm{A}+\mathrm{G} \rightarrow \mathrm{H}+\mathrm{F} \)
(8) \( \mathrm{K}+\mathrm{G}+\mathrm{M} \rightarrow \mathrm{N}+\mathrm{F} \)
(4) \( \mathrm{H}+\mathrm{I} \rightarrow \mathrm{K} \downarrow+\mathrm{L} \)
Quan sát hình 23.6, hãy xác định vị trí và tên gọi các cơ quan tương ứng với các chữ cái từ A đến D. Ghép tên mỗi cơ quan đó với chức năng phù hợp được mô tả dưới đây:1. Nâng đỡ cơ thể và vận chuyển các chất dinh dưỡng2. Tổng hợp chất dinh dưỡng cho cơ thể3. Hút nước và chất khoáng cho cơ thể4. Tạo ra quả và hạt
Đọc tiếp
Quan sát hình 23.6, hãy xác định vị trí và tên gọi các cơ quan tương ứng với các chữ cái từ A đến D. Ghép tên mỗi cơ quan đó với chức năng phù hợp được mô tả dưới đây:
1. Nâng đỡ cơ thể và vận chuyển các chất dinh dưỡng
2. Tổng hợp chất dinh dưỡng cho cơ thể
3. Hút nước và chất khoáng cho cơ thể
4. Tạo ra quả và hạt
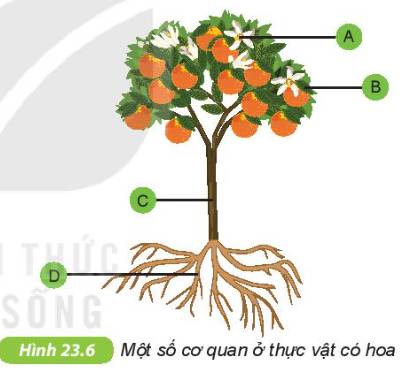
A. Hoa – 4. Tạo ra quả và hạt.
B. Lá – 2. Tổng hợp chất dinh dưỡng cho cơ thể.
C. Thân – 1. Nâng đỡ cơ thể và vận chuyển các chất dinh dưỡng.
D. Rễ – 3. Hút nước và chất khoáng cho cơ thể.
Đúng 0
Bình luận (0)
Câu 1: Cho các chất sau: P₂O₅, Na₂O, FeO, CO₂, K, Al, CaO. Xác định chất nào phản ứng được với H₂O. Viết PTHH minh họa
P2O5 + 3H2O => 2H3PO4
Na2O + H2O => 2NaOH
CO2 + H2O <=> H2CO3
K + H2O => KOH + 1/2H2
CaO + H2O => Ca(OH)2
Đúng 2
Bình luận (0)
Xác định các chất X1,X2,X3,X4 và viết PTHH của phản ứng theo sơ đồ sau:
X1 --> X2 --> C2H4 --> X3 --> Tinh bột --> X1 --> X4 --> SO2
Giúp mình vớiiii!
X1 : C6H12O6
X2 : C2H5OH
X3 : CO2
X4 : Ag
$C_6H_{12}O_6 \xrightarrow{t^o,xt} 2CO_2 + 2C_2H_5OH$
$C_2H_5OH \xrightarrow{t^o,xt} C_2H_4 + H_2O$
$C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O$
$6nCO_2 + 5nH_2O \xrightarrow{as} (C_6H_{10}O_5)_n + 6nO_2$
$(C_6H_{10}O_5)_n + nH_2O \xrightarrow{t^o,xt} nC_6H_{12}O_6$
${C_6}{H_{12}}{O_6} + 2AgN{O_3} + 3N{H_3}\xrightarrow{{}}{(C{H_2}OH)_5}COON{H_4} + 2Ag + 2N{H_4}N{O_3}$
$Ag +2 H_2SO_4 \to Ag_2SO_4 + SO_2 + 2H_2O$
Đúng 2
Bình luận (3)
Xác định chất phản ứng và chất tham gia trong các trường hợp sau
Câu 4. Xác định chất phản ứng và chất tham gia trong các trường hợp sau, viết phương trình chữ cho mỗi phản ứng, chỉ ra dấu hiệu cho thấy có phản ứng hoá học xảy ra.
(a) Khi đốt nến (làm bằng parafin), nến cháy trong không khí (có chứa 20% là oxygen) tạo ra khí carbon dioxide và hơi nước.
(b) Bỏ quả trứng vào dung dịch hydrochloric acid thấy sủi bọt khí ở vỏ. Biết rằng hydrochloric acid đã tác dụng với calcium carbonate (chất...
Đọc tiếp
Xác định chất phản ứng và chất tham gia trong các trường hợp sau
Câu 4. Xác định chất phản ứng và chất tham gia trong các trường hợp sau, viết phương trình chữ cho mỗi phản ứng, chỉ ra dấu hiệu cho thấy có phản ứng hoá học xảy ra.
(a) Khi đốt nến (làm bằng parafin), nến cháy trong không khí (có chứa 20% là oxygen) tạo ra khí carbon dioxide và hơi nước.
(b) Bỏ quả trứng vào dung dịch hydrochloric acid thấy sủi bọt khí ở vỏ. Biết rằng hydrochloric acid đã tác dụng với calcium carbonate (chất có trong vỏ trứng) tạo ra calcium chloride, nước và khí carbon dioxide.
Lập các PTHH sau, xác định phản ứng đó thuộc loại phản ứng nào?
Xác định chất là oxit trong các phản ứng. Phân loại oxit đó.
a) CaCO3- CaO + CO2
b) O2 + P -P2O5
c) Mg + H2SO4 -MgSO4 + H2
d) KClO3- KCl + O2
\(CaCO_3\underrightarrow{t^o}CaO\left(oxit.bazơ\right)+CO_2\left(oxit.axit\right)\) (phân huỷ)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\left(oxit.axit\right)\) (hoá hợp)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\) (thế)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\) (phân huỷ)
Đúng 2
Bình luận (0)
Dạng I: Viết PTHH của phản ứngBài 1: 1) Viết PTHH của phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho H2 lần lượt tác dụng với các chất: O2, PbO, Fe2O3, Fe3O4, CuO.2) Cacbon oxit (CO) có tính chất tương tự như H2 (tính khử). Viết PTHH của phản ứng xảy ra (ghi điều kiện phản ứng nếu có) khi cho CO lần lượt tác dụng với: O2; CuO; Fe3O4?Bài 2: Xác định các chất A; B và viết PTHH (ghi rõ điều kiện phản ứng) thực hiện chuyển đổi hóa học sau:H2O A B Fe3O4Dạng II: Nhận biết – Tách và tinh...
Đọc tiếp
Dạng I: Viết PTHH của phản ứng
Bài 1: 1) Viết PTHH của phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho H2 lần lượt tác dụng với các chất: O2, PbO, Fe2O3, Fe3O4, CuO.
2) Cacbon oxit (CO) có tính chất tương tự như H2 (tính khử). Viết PTHH của phản ứng xảy ra (ghi điều kiện phản ứng nếu có) khi cho CO lần lượt tác dụng với: O2; CuO; Fe3O4?
Bài 2: Xác định các chất A; B và viết PTHH (ghi rõ điều kiện phản ứng) thực hiện chuyển đổi hóa học sau:
H2O ![]() A
A ![]() B
B ![]() Fe3O4
Fe3O4
Dạng II: Nhận biết – Tách và tinh chế chất:
Bài 3: Có 4 bình khí A, B, C, D mỗi bình chứa 1 trong các chất khí sau: khí cacbonic, khí oxi, khí hiđro, không khí. Biết rằng:
- Khí trong bình A làm đục nước vôi trong.
- Hỗn hợp của khí trong bình B và D là hỗn hợp nổ.
- Khí D làm CuO (màu đen) chuyển sang màu đỏ khi nung nóng.
Xác định chất khí đựng trong các bình A, B, C, D và viết PTHH của các phản ứng xảy ra?
Bài 4: Có hỗn hợp khí gồm H2, CO2.
1) Trình bày cách để loại bỏ CO2 ra khỏi hỗn hợp? Viết PTHH của phản ứng xảy ra?
2) Tách riêng H2 và CO2 ra khỏi hỗn hợp trên?
Dạng III: Phương pháp bảo toàn khối lượng và bảo toàn nguyên tố
Bài 5: Dẫn luống khí H2 dư qua ống sứ đựng 24 gam hỗn hợp gồm CuO và Fe2O3 (![]() ) nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn.
) nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn.
1) Viết PTHH của phản ứng xảy ra?
2) Không dựa vào PTHH hãy:
a) Tính thể tích khí H2 (đktc) đã tham gia phản ứng?
b) Tính m?
Bài 6: Dẫn hỗn hợp X gồm H2 và CO từ từ đến dư qua ống sứ đựng 19,6g hỗn hợp A gồm CuO và Fe3O4 (trong đó CuO chiếm 40,82% về khối lượng), sau khi các phản ứng xảy ra hoàn toàn thu được hỗn hợp khí và hơi Y (gồm CO2 và hơi nước). Chất rắn B thu được trong ống sứ khối lượng giảm m gam so với hỗn hợp A ban đầu.
1) Viết PTHH của phản ứng xảy ra?
2) Tính m và khối lượng của hỗn hợp B?
3) Khối lượng của Y nặng hay nhẹ hơn khối lượng hỗn hợp X ban đầu? bao nhiêu gam? Tính tổng thể tích hỗn hợp A đã tham gia phản ứng?
Bài 7: Hỗn hợp X gồm Al; Mg; Zn.
- Cho m gam hỗn hợp X tác dụng hết với dung dịch H2SO4 loãng thấy thoát ra 8,96 lít H2 (đktc).
- Mặt khác, đốt cháy hoàn toàn m gam hỗn hợp X cần dùng vừa đủ V lít O2 (đktc).
1) Viết PTHH của phản ứng xảy ra?
2) Tính V? (Phương pháp ghép ẩn)
Dạng IV: Bài toán: Tính theo PTHH – tăng, giảm khối lượng
Bài 8: Người ta tiến hành thí nghiệm sau:
- Đặt lên 2 đĩa cân (cân Robecvan): Đĩa cân A: cốc đựng dung dịch HCl; đĩa cân B: cốc đựng dung dịch H2SO4 loãng. Cân ở vị trí thăng bằng.
- Thêm vào cốc A một dây Mg có khối lượng 3,6g; thêm vào cốc B lá nhôm có khối lượng 5,4g. Để cho toàn bộ kim loại tan hết.
1) Viết PTHH của các phản ứng xảy ra?
2) So sánh thể tích khí thoát ra ở 2 cốc?
3) Xác định trạng thái của cân sau thí nghiệm? Cần phải thêm nước vào cốc nào? Bao nhiêu gam nước để cân trở lại vị trí thăng bằng?
Bài 9: Người ta tiến hành thí nghiệm sau:
- Đặt lên 2 đĩa cân (cân Robecvan): Đĩa cân A: cốc đựng dung dịch HCl; đĩa cân B: cốc đựng dung dịch H2SO4 loãng. Cân ở vị trí thăng bằng.
- Thêm vào cốc A vài viên Zn có khối lượng a gam; thêm vào cốc B lá nhôm có khối lượng b gam. Sau khi toàn bộ kim loại tan hết, thấy cân vẫn ở vị trí thăng bằng.
1) Viết PTHH của các phản ứng xảy ra
2) Tính a/b?
Dạng V: Bài toán: Xác định thành phần hỗn hợp – Nồng độ dung dịch
Bài 10: Khử hoàn toàn 32g hỗn hợp X gồm CuO và Fe2O3 bằng khí H2 ở nhiệt độ cao. Sau phản ứng thu được 24g hỗn hợp Y gồm 2 kim loại.
1) Viết PTHH của phản ứng xảy ra?
2) Tính thể tích H2 (đktc) đã tham gia phản ứng?
3) Tính thành phần % về khối lượng mỗi oxit trong X?
Bài 11: Cho 6,06g hỗn hợp A gồm Al và Zn tác dụng với 200g dung HCl 6,935%. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và thoát ra 4,032 lít H2 (đktc).
1) Viết PTHH của phản ứng xảy ra?
2) Chứng tỏ rằng, hỗn hợp A tan hết; HCl còn dư.
3) Tính tổng khối lượng muối có trong dung dịch B?
4) Tính thành phần % về khối lượng mỗi kim loại trong A?
5) Tính nồng độ % của các chất trong dung dịch B?
Bài 12: Hoà tan 3,87g hỗn hợp kim loại gồm Mg và Al trong 250 ml dung dịch HCl 2M thu được dung dịch A và khí B.
1) Viết PTHH của phản ứng xảy ra?
2) Chứng minh rằng sau phản ứng với Mg và Al thì axit vẫn còn dư.
3) Nếu thể tích khí B thu được là 4,368 lit (đktc):
a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b) Tính nồng độ mol của các chất trong dung dịch A? Coi thể tích dung dịch không thay đổi trong quá trình phản ứng?
Bài 13: Khử hoàn toàn 24g hỗn hợp X gồm CuO và Fe2O3 bằng V lít (đktc) hỗn hợp khí A gồm CO và H2 (vừa đủ). Sau phản ứng thu được m gam hỗn hợp Y (gồm 2 kim loại); hỗn hợp khí và hơi B (CO2; hơi nước) nặng hơn hỗn hợp A ban đầu 6,4g.
1) Viết PTHH của các phản ứng xảy ra?
2) Tính m và V?
3) Tính khối lượng mỗi oxit trong X?
Dạng VI: Bài toán: Xác định CTHH của chất
Bài 14: Hoà tan hoàn 18,4g kim loại M (hoá trị II) và N (hoá trị III) trong dung dịch HCl thu được dung dịch Q và 11,2 lít H2 (đktc). Cô cạn dung dịch Q thu được m gam muối khan.
1) Tính m?
2) Xác định tên 2 kim loại M, N. Biết rằng trong hỗn hợp tỉ lệ số mol nM : nN = 1: 1và 2MN < MM < 3MN
Bài 15: Khi lấy 6,72 lít H2 ở trên khử vừa đủ 19,6 gam hỗn hợp CuO và FexOy tạo ra hỗn hợp kim loại C, ngâm hỗn hợp kim loại C trong dung dịch HCl dư thu được 3,36 lít H2. Biết: các thể tích đo ở điều kiện tiêu chuẩn; Cu không tác dụng với dung dịch HCl.
1) Tính khối lượng hỗn hợp C.
2) Xác định công thức oxit sắt?
Bài 16: Cho 11,6 gam MxOy vào ống sứ, nung nóng và dẫn 8,96 lít khí CO (đktc) đi qua. Khi phản ứng xảy ra hoàn toàn thu được chất rắn và hỗn hợp khí Y có tỉ khối so với khí oxi là 1,125. Tìm công thức oxit.
Bài 17: Khử hoàn toàn 3,48g một oxit kim loại RxOy cần dùng 1,344 lít H2. Toàn bộ lượng kim loại thu được cho tác dụng với dung dịch HCl dư thu được 1,008 lít khí. Các thể tích khí đo ở đktc. Xác định kim loại M và oxit của nó?
bài 1: 1) 2H2+ O2 -to-> 2H2O
PbO + H2 -to-> Pb + H2O
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
Fe3O4 + 2H2 -to-> 3Fe + 2H2O
CuO + H2 -to-> Cu + H2O
b) O2 + 2CO -to-> 2CO2
CuO + CO -to-> Cu + CO2
Fe3O4 + 4CO -to-> 3Fe + 4CO2
Đúng 0
Bình luận (0)
bài 3
khí trong bình A là CO2 pthh CO2 + 2Ca(OH) --> 2CaCO3 + H2O
khí B là O2 khí D là H2 pthh 2H2 + O2 --> 2H2O
CuO +H2 -to-> Cu + H2O
khí C là không khí
Đúng 0
Bình luận (0)
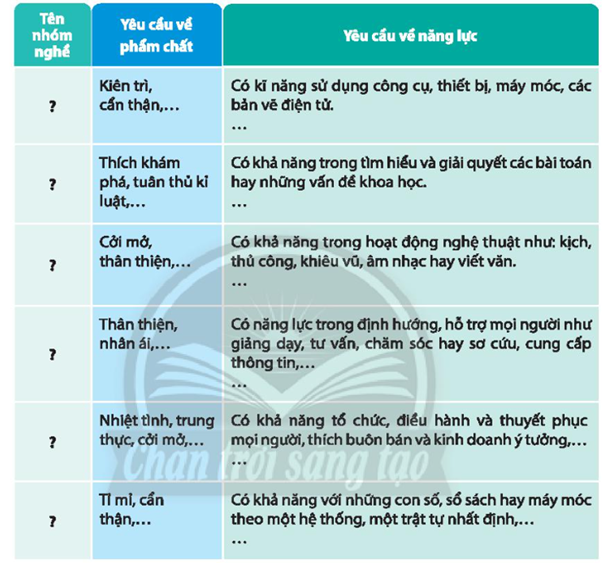
Xác định tên nhóm nghề tương ứng với các yêu cầu về phẩm chất và năng lực.
Phương pháp giải:
Tên các nhóm nghề tương ứng với phẩm chất và năng lực trong bảng trên là gì ?
1. Nhóm nghề điện tử.
2. Nhóm nghề an ninh, quốc phòng.
3. Nhóm nghề dịch vụ.
4. Nhóm nghề khoa học giáo dục và đào tạo giáo viên
5. Nhóm nghề kinh doanh.
6. Nhóm nghề toán thống kê
Đúng 0
Bình luận (0)
Kể tên các chất tác dụng vs H2SO4 và viết PTHH tương ứng
-sản xuất phân bón, thuốc trừ sâu, chất giặt tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn màu
Đúng 0
Bình luận (0)
* KIM LOẠI TÁC DỤNG VỚI AXIT H2SO4 LOÃNG
Kim loại ( đứng trước H trong dãy hoạt động hóa học của kim loại ) + H2SO4 loãng ---> Muối + Hiđro
VD:
1) Fe + 2HCl -> FeCl2 + H2 (bay hơi);
2) 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (bay hơi);
* Kim loại tác dụng với H2SO4 đặc nóng ---> Muối (hóa trị cao)+nước+SO2
VD: Cu + 2H2SO4 đặc nóng \(\underrightarrow{t^o}\) CuSO4 + SO2 (bay hơi) + 2H2O.
* Oxit kim loại đạt mức hóa trị cao + H2SO4 đặc -> Muối +H2O
VD: Fe2O3+H2SO4 -> Fe2(SO4)3 + H2O
* Oxit kim loại mà trong đó KL chưa đạt mức hóa trị cai như FeO,Fe3O4,CrO,Cu2O... tác dụng với dd H2SO4 đặc thì sp tạo ra gồm muối hóa trị cao của kim loại ( Fe III, Cr III, Cu II..) + H2O + một trong các sp sau:
-SO2 (khí ko màu,mùi hắc);
-H2S (khí ko màu,mùi trứng thối);
-S(chất rắn)
VD: 2CrO+4H2SO4 ---> Cr2(SO4)3 +SO2+H2O
Đúng 0
Bình luận (0)






















