Bài 1: Tính khối lượng ZnO tạo ra khi cho 0,25 mol Zn phản ứng với khí O2 dư.
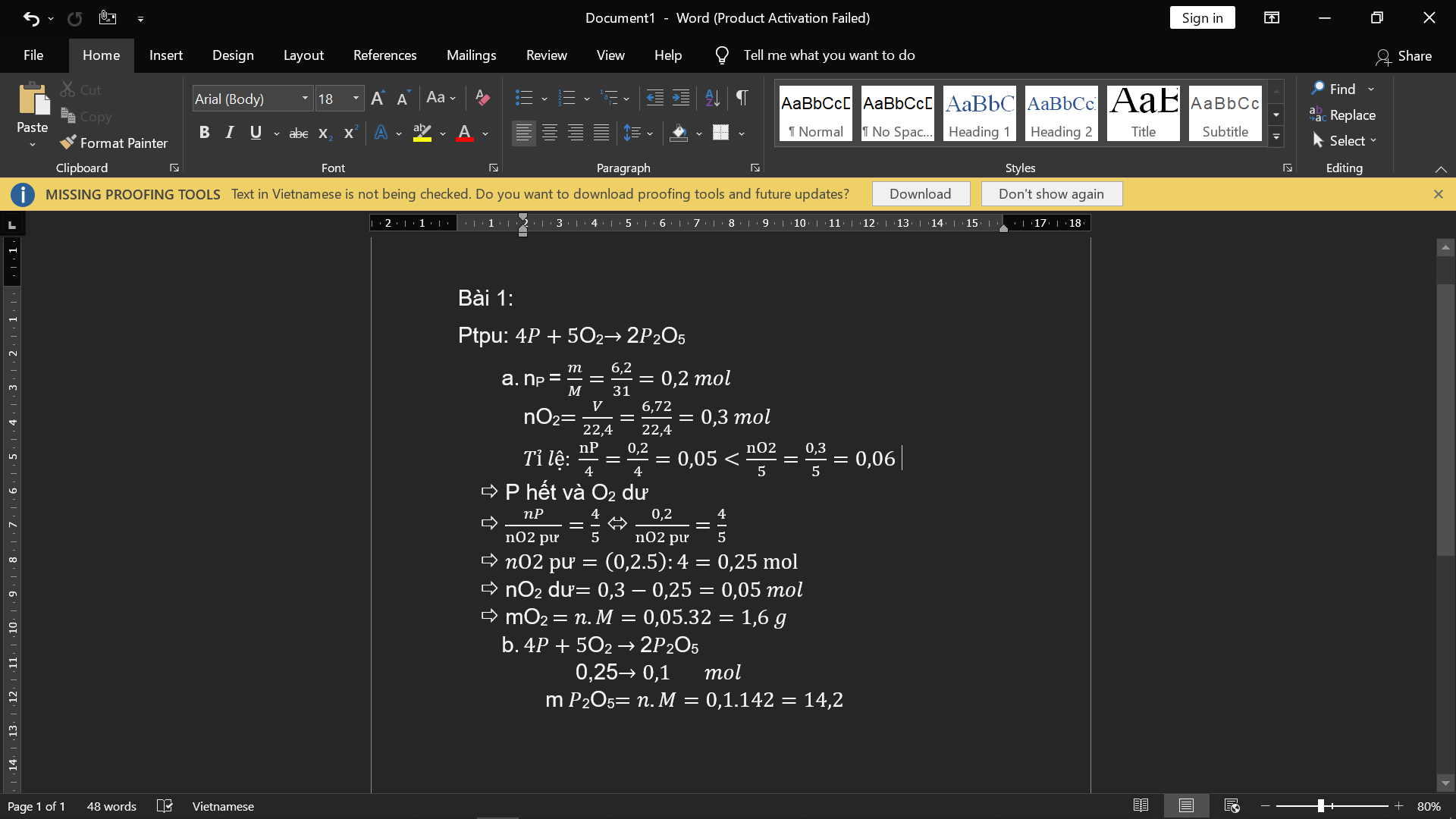
Bài 1: Đốt cháy 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc.
a. Sau phản ứng chất nào còn dư và nếu dư thì với khối lượng bao nhiêu? b. Tính khối lượng sản phẩm thu được.
Bài 2: Cho 13g Zn tác dụng với 0,3 mol HCl sau khi kết thúc phản ứng thu được muối kẽm Clorua và khí H2.
a. Viết và cân bằng PTPƯ và cho biết sau khi kết thúc phản ứng thì chất nào còn dư và nếu dư thì dư với khối lượng bao nhiêu?.
b. Tính thể tích của H2 thu được.
Bài 3: Người ta cho 26 g kẽm tác dụng với 49 g H2SO4, sau phản ứng thu được muối ZnSO4, khí hidro và chất còn dư.
a. Viết phương trình phản ứng.
b. Tính thể tích (đktc) khí hidro sinh ra.
c. Tính khối lượng các chất còn lại sau phản ứng.
Bài 4: Nếu cho 4 gam CuO tác dụng với 2,92 g HCl.
a) Cân bằng PTHH.
b) Tính khối lượng các chất còn lại sau phản ứng.
Bài 5: Hòa tan hoàn toàn 15gam CaCO3 vào 200mL dung dịch HCl 2M.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ mol của các chất tan có trong dung dịch thu được.
Bài 6: Hòa tan hết 4,8 gam Magie vào 200 gam dung dịch H2SO4 loãng nồng độ 20%.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ chất tan có trong dung dịch sau phản ứng.
Bài 7: Cho 200 ml dung dịch NaOH nồng độ 2M vào 200 mL dung dịch HCl 4M.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ mol của chất tan trong dung dịch sau phản ứng.
Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)
b ơi đây là bài 1 nka, tí mk làm xog sẽ gửi típ nka ![]()
Cho 12,8g Zn tác dụng với axitclohiđric . Sau phản ứng thấy có khí thoát ra , người ta thu khí vào bình và cho chúng tác dụng với một lượng O2 dư . Tính khối lượng chất tạo thành .
đề có sai chỗ nào ko vậy
mik thấy thay Zn bằng Cu hợp lí hơn
$Zn + 2HCl \to ZnCl_2 + H_2$
Theo PTHH :
$n_{H_2} = n_{Zn} = \dfrac{12,8}{65} = 0,197(mol)$
$2H_2 + O_2 \xrightarrow{t^o} 2H_2O$
Theo PTHH :
$n_{H_2O} = n_{H_2} = 0,197(mol)$
$m_{H_2O} = 0,197.18 = 3,546(gam)$
\(n_{Zn}=\dfrac{12,8}{65}=\dfrac{64}{325}\left(mol\right)\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ H_2+\dfrac{1}{2}O_2\underrightarrow{^{to}}H_2O\\ n_{H_2O}=n_{ZnCl_2}=n_{H_2}=n_{Zn}=\dfrac{64}{325}\left(mol\right)\\ m_{H_2O}=\dfrac{64}{325}.18\approx3,545\left(g\right)\\ m_{ZnCl_2}=\dfrac{64}{325}.136\approx26,782\left(g\right)\)
c) Cho 12,8g Zn tác dụng với axit clohiđric. Sau phản ứng thấy có khí thoát ra, người ta thu khí vào bình và cho chúng tác dụng với một lượng O2 dư. Tính khối lượng chất tạo thành.
nZn=\(\dfrac{m}{M}=\dfrac{12,8}{65}=0,197\left(mol\right)\)
pthh:
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
0,197..0,394.....0,197...0,197(mol)
2H2 + O2 \(\rightarrow\) 2H2O
0,197................0,197
mH2O=n.M=0,197.18=3,546(g)
Hỗn hợp bột X gồm Cu, Zn. Đốt cháy hoàn toàn m gam X trong oxi (dư), thu được 40,3 gam hỗn hợp gồm CuO và ZnO. Mặt khác, nếu cho 0,25 mol X phản ứng với một lượng dư dung dịch KOH loãng nóng, thì thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Cu trong X là:
A. 19,81%
B. 29,72%
C. 39,63%
D. 59,44%
Đáp án C
nZn = nH2 = 0,15 => nCu = 0,1 mol
=> %Cu = 0,1 . 64 /( 0,1 . 64 + 0,15 . 65) = 39,63%
câu 1: tính thể tích khí oxi cần dùng khi cho 5,6 g Fe tác dụng để tạo ra Fe2O3 tính khối lượng Fe2O3 tạo thành biết hiệu suất của phản ứng 85%
câu 2: ZnSO4-(1)-> Zn(OH)2--(2)->ZnO--(3)->Zn--(4)->ZnCl2--(5)->Zn(NO3)2
Fe--(1)->FeCl2--(2)-> FeSO4--(3)->Fe(OH)2--(4)-> FeO--(5)-> Fe
câu 3: Trình bày phương pháp khử chua đât trồng trọt viết phương trình về phản ứng minh họa
câu 4: tính thành phần % theo khối lượng của từng nguyên tố trong hợp chất Fe2O3; Al2(SO4)3
giúp mik nha ^^ mik đang cần gấp
\(1.n_{Fe}=0,1\left(mol\right)\\ 4Fe+3O_2-^{t^o}\rightarrow2Fe_2O_3\\ n_{O_2}=\dfrac{3}{4}n_{Fe}=0,075\left(mol\right)\\ \Rightarrow V_{O_2}=0,075.22,4=1,68\left(l\right)\\ n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,05\left(mol\right)\\ VìH=85\%\Rightarrow m_{Fe_2O_3}=0,05.160.85\%=6,8\left(g\right)\)
Câu 3: - Khi đất trồng bị chua, để giảm độ chua tăng pH người ta thường bón những chất có tính chất kiềm cho đất như Ca(OH)2 vì nó tác dụng với axit trong đất theo phản ứng trung hòa và giá thành rẻ
Ca(OH)2+H2SO4→CaSO4+2H2O
4. \(M_{Fe_2O_3}=56.2+16.3=160\\ \%Fe=\dfrac{56.2}{160}.100=70\%\\ \%O=100-70=30\%\\ M_{Al_2\left(SO_4\right)_3}=27.2+96.3=342\\ \%Al=\dfrac{27.2}{343}.100=15,79\%\\ \%S=\dfrac{32.3}{342}.100=28,07\%\\ \%O=\dfrac{16.12}{342}.100=56.14\%\)
Cho 6,72(lít) khí H2 phản ứng với 8,96(lít) khí O2(các thể tích khí đo ở điều kiện tiêu chuẩn)
a) Sau phản ứng chất nào hết, chất nào dư, tính khối lượng chất dư?
b) Tính số phân tử H2O tạo ra sau phản ứng
c) Khối lượng O2 tham gia vào phản ứng trên được điều chế từ KMnO4 hãy tính khối lượng KMnO4 cần dùng
\(a,n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
bđ 0,3 0,4
pư 0,3 0,15
sau pư 0 0,25 0,3
=> H2 hết, O2 dư
\(m_{O_2\left(dư\right)}=0,25.32=8\left(g\right)\)
b) \(A_{H_2O}=0,3.6.10^{23}=1,8.10^{23}\left(phân.tử\right)\)
c) \(m_{O_2\left(pư\right)}=0,15.32=4,8\left(g\right)\)
PTHH: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,3<-------------------------------------0,15
\(\rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Bài 2 : cho 6,72 lít khí H2 phản ứng với 8,96 lít khí O2(các thể tích đo ở đktc)
a)Sau phản ứng ,chất nào hết ?Chất nào dư?Tính khối lượng chất dư?
b) Tính số phân tử H2 tạo ra sau phản ứng
c)Lượng oxi tham gia phản ứng trên được điiều chế từ KMnO4.Xác định khối lượng KMnO4
a) Số mol khí H2 và khí O2 lần lượt là 6,72:22,4=0,3 (mol) và 8,96:22,4=0,4 (mol).
2H2 (0,3 mol) + O2 (0,15 mol) \(\rightarrow\) 2H2O (0,3 mol). Do 0,3:2<0,4 nên sau phản ứng, khí H2 hết, khí O2 dư và dư (0,4-0,15).32=8 (g).
b) Số phân tử nước tạo ra sau phản ứng là 0,3.NA (phân tử) với NA là hằng số Avogadro.
c) 2KMnO4 (0,3 mol) \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2 (0,15 mol).
Khối lượng cần tìm là 0,3.158=47,4 (g).
Bài 1: NaOH + HCl -> NaCl + H2O
2H2 + O2 -> 2H2O
Cho khối lượng của NaOH là 4gam. Tính thể tích khí O2 cần dùng để tạo ra lượng H2O bằng lượng H2O trong phản ứng của NaOH với HCl
Bài 2: Cho số Avogadro=6x1023 . Trong 0,69 mol KMnO4 có bao nhiêu nguyên tử
Bài 3: CH4 + 2Cl2 -> CH2Cl2 + 2HCl ( đk: á/s, 1:2 ). Cho thể tích của CH4 là 17,92 lít, của Cl2 là 11200 cm3. Tính thể tích Ba(OH)2 được trung hòa bằng lượng HCl tạo thành, biết:
Ba(OH)2 + 2HCl -> BaCl2 + 2H2O
Bài 4: Trong điều kiện 25oC và 0,22 atm, có 7,77 lít khí O2. Lượng khí Oxi trên có phản ứng đủ với 0,1 mol Fe theo phản ứng: 3Fe + 2O2 -> Fe3O4 không ? (Làm tròn mol khí O2 đến 2 chữ số sau dấu phẩy)
\(Tacó:n=\dfrac{A}{N}\\ Sốnguyêntử:A=0,69.6.10^{23}=4,14.10^{23}\left(nguyêntử\right)\)
Trong 0,69 mol KMnO4 có số phân tử là:
\(0,69.6.10^{23}=4,14.10^{23}\left(phân.tử\right)\)
Cho Zn tác dụng vs O2 theo sơ đồ: Zn + O2---> ZnO.
Tính khối lượng Zn tham gia phản ứng để tạo thành 160g ZnO. Biết rằng phản ứng đã dùng hết 30g O2
2Zn+O2-->2ZnO
Áp dụng định luật bảo toàn khối lượng ta có
m Zn=m ZnO-m O2=160-30=130(g)