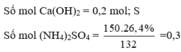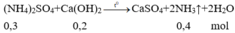cho mik hỏi:
Câu1: Đốt cháy 15,5 gam P trong V lít khí O2 (đktc) thu được m gam P2O5. Tìm V, m.
Câu2:Đốt cháy 15,5 gam P trong 11,2 lít khí O2 (dktc) thu được m gam P2O5. Tìm m.

Những câu hỏi liên quan
Đốt cháy hoàn toàn m gam Photpho trong không khí thu được hợp chất điphotpho pentaoxit P2O5. Tính khối lượng của photpho cần dùng để phản ứng đủ với 3,36 lít khí O2 (đktc)
\(n_{O_2\left(đktc\right)}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ 4P+5O_2\underrightarrow{^{to}}2P_2O_5\\ 0,12........0,15.........0,06\left(mol\right)\\ m_P=0,12.31=3,72\left(g\right)\)
Đúng 4
Bình luận (0)
Ta có: \(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 4P + 5O2 ---to---> 2P2O5.
Theo PT: nP = \(\dfrac{4}{5}.n_{O_2}=\dfrac{4}{5}.0,15=0,12\left(mol\right)\)
=> mP = 31 . 0,12 = 3,72(g)
Đúng 0
Bình luận (0)
Đốt cháy 9,3 gam photpho (P) cần dùng V lít O2(đktc) tạo thành m gam P2O5 theo phương trình: P + O2 → P2O5. Cân bằng phương trình phản ứng trên? Tính m, V ?
ai giúp mik dc ko ? mik dag cần gấp
\(n_P=\dfrac{9.3}{31}=0.3\left(mol\right)\)
\(4P+5O_2\underrightarrow{^{^{t^0}}}2P_2O_5\)
\(0.3.....0.375.....0.15\)
\(V_{O_2}=0.375\cdot22.4=8.4\left(l\right)\)
\(m_{P_2O_5}=0.15\cdot142=21.3\left(g\right)\)
Đúng 1
Bình luận (0)
PT: 4P + 5O2 → 2P2O5.
Ta có: nP= 9,3/31=0,3(mol)
Theo PT: nO2= 5/4 . nP=5/4 . 0,3=0,375(mol)
=> VO2=0,375.22,4=8,4(lít)
Theo PT: nP2O5=1/2 . nP=1/2 . 0,3=0,15(mol)
=> mP2O5= 0,15.142=21,3(g)
Đúng 0
Bình luận (0)
Đốt cháy 9,3 gam photpho (P) cần dùng V lít O2(đktc) tạo thành m gam P2O5 theo phương
trình: P + O2 → P2O5. Cân bằng phương trình phản ứng trên? Tính m, V ?
PTHH: \(4P+5O_2\xrightarrow[]{t^o}2P_2O_5\)
Ta có: \(n_P=\dfrac{9,3}{31}=0,3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,375\left(mol\right)\\n_{P_2O_5}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,375\cdot22,4=8,4\left(g\right)\\m_{P_2O_5}=0,15\cdot142=21,3\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 14,8 gam
Ca
OH
2
vào 150 gam dung dịch
NH
4
2
S
O
4
26,4% rồi đun nóng nhẹ thu được V lít khí (đktc). Để đốt cháy hết V lít khí trên cần vừa đủ lượng
O
2
thu được khi nung m gam
KClO
3
(có xúc tác). Giá tr...
Đọc tiếp
Cho 14,8 gam Ca OH 2 vào 150 gam dung dịch NH 4 2 S O 4 26,4% rồi đun nóng nhẹ thu được V lít khí (đktc). Để đốt cháy hết V lít khí trên cần vừa đủ lượng O 2 thu được khi nung m gam KClO 3 (có xúc tác). Giá trị của m là
A. 73,5.
B. 49.
C. 24,5.
D. 12,25.
Hỗn hợp X gồm
A
l
,
C
a
,
A
l
4
C
3
v
à
C
a
C
2...
Đọc tiếp
Hỗn hợp X gồm A l , C a , A l 4 C 3 v à C a C 2 .Cho 15,5 gam X vào nước dư, chỉ thu được dung dịch Y và khí Z. Đốt cháy hoàn toàn Z, thu được 4 , 48 l í t C O 2 (đktc) và 9 , 45 g a m H 2 O .Thêm từ từ dung dịch HCl 1 M vào Y, khi hết V lít hoặc 2V lít thì đều thu được m gam kết tủa. Giá trị của m là
A. 13,26
B. 14,04
C. 15,60
D. 14,82
Đáp án D
Quy về Al, Ca và C ⇒ n C = n C O 2 = 0 , 2 m o l
Đặt n A l = x ; n C a = y
![]()
![]()
![]()
![]()
![]()
![]()
⇒ áp dụng công thức: n H + = 4 n A l O 2 - - 3 n
![]()
![]()
⇒ m = 14 , 82 g
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi (đktc) thu được hh khí X có 4,4 gam CO2 và 1,6 gam O2 dư. Tính tỉ lệ phần trăm khối lượng, tỉ lệ phần trăm thể tích của O2 trong X. Tính m, V
Giúp mình với, cảm ơn trc nha ^^
$\%m_{O_2(X)}=\dfrac{1,6}{1,6+4,4}.100\%=26,67\%$
$n_{CO_2}=\dfrac{4,4}{44}=0,1(mol);n_{O_2}=\dfrac{1,6}{16}=0,05(mol)$
$\Rightarrow \%V_{O_2(X)}=\dfrac{0,05}{0,05+0,1}.100\%=33,33\%$
$C+O_2\xrightarrow{t^o}CO_2$
Theo PT: $n_C=n_{O_2(p/ứ)}=n_{CO_2}=0,1(mol)$
$\Rightarrow n_{O_2(dùng)}=0,1+0,05=0,15(mol)$
$m_C=0,1.12=1,2(g);V_{O_2(dùng)}=0,15.22,4=3,36(lít)$
$\to m=1,2;V=3,36$
Đúng 4
Bình luận (0)
Đốt cháy hoàn toàn 0,1 mol ancol propylic cần V lít O2 (đktc) thu được khí CO2 (đktc) và m gam nước. Tìm giá trị V và m
PTHH: C3H7OH + \(\dfrac{9}{2}\)O2 --to--> 3CO2 + 4H2O
0,1-->0,45---------------->0,4
=> V = 0,45.22,4 = 10,08 (l)
mH2O = 0,4.18 = 7,2 (g)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 0,1 mol ancol propylic cần V lít O2 (đktc) thu được khí CO2 (đktc) và m gam nước. Tìm giá trị V và m
PTHH: C3H7OH + \(\dfrac{9}{2}\)O2 --to--> 3CO2 + 4H2O
0,1-->0,45---------------->0,4
=> V = 0,45.22,4 = 10,08 (l)
mH2O = 0,4.18 = 7,2 (g)
Đúng 4
Bình luận (0)
C3H7(OH) + 9/2 O2 --->3CO2 +4H2O
0,1 0,45 0,4
--->VO2=0,45.22,4=10,08l
mH2O=0,4.18=7,2g
Đúng 1
Bình luận (0)