Một oxit kim loại chứa 52,94% kim loại (về khối lượng). Hãy XĐ công thức phân tử của oxit đó

Những câu hỏi liên quan
Một oxit kim loại có khối lượng mol là 102g , thành phần phần trăm theo khối lượng của kim loại trong oxit là 52,94% . Xác định công thức của oxit đó ?
Hóa học 8.
Một oxit kim loại có khối lượng mol là 102g, thành phần % về khối lượng của kim loại trong oxit là 52,94%. Xác định công thức của oxit đó
Gọi công thức oxit là \(R_xO_y\)
\(M_{R_xO_y}=Rx+16y=102\)
\(\%R=\frac{Rx.100}{Rx+16y}\)
\(\Leftrightarrow52,94=\frac{Rx.100}{102}\)
\(\Leftrightarrow Rx=\frac{52,94.102}{100}\approx54\)
\(\Leftrightarrow R=\frac{54}{x}\)
Với \(x=1\Rightarrow R=54\left(l\right)\)
Với \(x=2\Rightarrow R=27\left(Al\right)\)
Với \(x=3\Rightarrow R=18\left(l\right)\)
Vậy công thức oxit cần tìm là \(Al_2O_3\)
(Không chắc)
https://i.imgur.com/U6SelLE.jpg
cho 1 oxit kim loại trong đó kim loại chiếm 52,94% về khối lượng. Hãy xác định oxit kim loại đó.
( bài này trẫm biết làm rồi, ko cần trả lời đâu )
Vì M chiếm 52.94% nên O chiếm 47.06%
Nếu M hóa trị 1 công thức oxit cao nhất là: M2O
Có: \(O\%=\frac{16}{16+2M_M}=47,06\%\)
Nên: MM = 9
Nếu M hóa trị II công thức MO.
\(O\%=\frac{16}{16+M_M}=47,06\%\)
Nên: MM = 18
Nếu M hóa trị III công thức M2O3
\(O\%=\frac{16}{32+3M_M}=47,02\%\)
=> MM = 12
*P/s: Linh vkl, thưa bệ hạ, tại hạ vừa học 1 dạng giống thế này cực luôn*
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho biết khối lượng mol của một oxit kim loại là 160gam, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit kim loại đó.
Đặt công thức của oxit kim loại là MxOy
%mO = 100% - 70% = 30%
⇒ mO = 12y = 160.30% = 48
⇒ y = 3
mM = 160.70% = 112g = M.x (với M là phân tử khối của kim loại M)
Áp dụng quy tắc hóa trị ta có:
a.x = 2.3 = 6 (với a là hóa trị của M; a = 1; 2; 3)
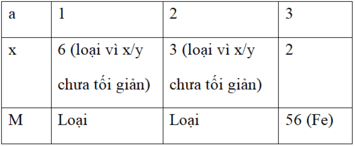
⇒ M là kim loại Sắt.
Vậy công thức hóa học của oxit kim loại là Fe2O3 (Sắt (III) oxit).
Đúng 2
Bình luận (0)
1.Oxit cao nhất của 1 nguyên tố R có dạng R2Ox. Phân tử khối của oxit là 102 đvC. Xác định R.
2. Cho biết phân tử khối của một oxit kim loại là 160, phần trăm khối lượng của kim loại trong
oxit là 70%. Lập công thức oxit đó.
1)
PTKR2Ox = 2.NTKR + 16x = 102 (đvC)
| x | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| NTKR | 43(Loại) | 35(Loại) | 27(Al) | 19(Loại) | 11(Loại) | 3(Loại) | Loại | Loại |
=> R là Al
2)
CTHH: RxOy
\(\%R=\dfrac{x.NTK_R}{160}.100\%=70\%\)
=> \(NTK_R=\dfrac{112}{x}\left(đvC\right)\)
Chỉ có x = 2 thỏa mãn \(NTK_R=\dfrac{112}{2}=56\left(đvC\right)\)
=> R là Fe
PTKFe2Oy = 160 (đvC)
=> y = 3
CTHH: Fe2O3
Đúng 2
Bình luận (0)
Cho biết khối lượng mol một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit đó
\(CT:M_xO_y\)
\(\%M=\dfrac{xM}{160}\cdot100\%=70\%\)
\(\Rightarrow xM=112\)
\(\text{Với : }\) \(x=2\Rightarrow M=56\)
\(M=56\cdot2+16y=160\left(g\text{/}mol\right)\)
\(\Rightarrow y=3\)
\(CT:Fe_2O_3:\text{Sắt (III) oxit}\)
Đúng 4
Bình luận (0)
Cho biết phân tử của 1 oxit kim loại là 160g, % theo khối lượng của km loại trong oxit là 70%. Lập công thức oxit đó.
Gọi CTTQ của oxit kim loại là R2On.
Có: 2R + 16n = 160 (1)
Lại có %R = 2R/2R + 16n = 70% <=> 2R = 160 . 70% => R = 56 (Fe)
Thay R = 56 vào (1): 2 . 56 + 16n = 160 => n = 3
Vậy công thức oxit cần tìm là Fe2O3.
Đúng 1
Bình luận (0)
Cho biết khối lượng mol một oxit của kim loại là 160g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hoá học của oxit. Gọi tên oxit đó.
Cho biết khối lượng mol của một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70. Lập công thức hóa học của oxit. Gọi tên oxit đó.
Khối lượng của kim loại có trong oxit kim loại:
MKL = 112 g
Khối lượng nguyên tố oxi: mO = 160 – 112 = 48g
Đặt công thức hóa học của oxit kim loại là MxOy, ta có:
MKL. x = 112 => nếu x = 2 thì M = 56. Vậy M là Fe
16y = 48 => y = 3
Vậy CTHH: Fe2O3, đó là sắt (III) oxit
Đúng 0
Bình luận (0)
Hoan hô , Học sinh tự hỏi tự trả lời
Hoan hô oooooooooooooooooooooooooooo
Đúng 2
Bình luận (0)

























