Câu 4. Nguyên tố oxi có 3 đồng vị 16O chiếm 99,757% ; 17O chiếm 0,039%; 18O chiếm 0,204%. Nguyên tử khối trung bình của oxi :
A. 16,000 B. 16,012 C. 16,023 D. 16,004
Oxi tự nhiên có 3 đồng vị là 99,757% 16O; 0,039% 17O; 0,204% 18O.
Tính % đồng vị 16O trong phân tử HClO3 ( H=1, Cl =35,5).
Oxi tự nhiên là một hỗn hợp các đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O
Khi có 1 nguyên tử 17O, mà % nguyên tử của 17O = 0,039%
⇒ Số nguyên tử O = 1 : 0,039% = 2564 nguyên tử
99,757% 16O ⇒ Số nguyên tử 16O = 99,757%.2564 = 2558 nguyên tử
0,204% 18O ⇒ Số nguyên tử 18O = 0,204%.2564 = 5 nguyên tử
Oxi tự nhiên là một hỗn hợp các đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O
Tại sao lại lấy 1/0,039% vậy ạ
Vì 1 ntử 17O chiếm 0,039% nên lấy 1/0,039% để tính tổng các ntử của các đồng vị khác
trong tự nhiên nguyên tố oxi tồn tại 3 đồng vị bền trong đó 16O chiếm 99,76%, 17O chiếm 0,039%, 18O chiếm 0,201%. tính nguyên tử khối trung bình của oxi
\(\overline{M}_O=\dfrac{16.99,76+17.0,039+18.0,201}{100}=16\left(g/mol\right)\)
Tính nguyên tử khối trung bình của nguyên tố Oxi, biết Oxi có 3 đồng vị : 99,757% 816O; 0,039% 817O; 0,204% 818O .
Câu 1. Trong tự nhiên, nguyên tố cacbon có hai đồng vị: 12C và 13C, nguyên tố oxi có ba đồng vị: 16O, 17O và 18O. Số loại phân tử CO2 khác nhau có thể tạo thành từ các đồng vị trên là
A. 12. B. 9. C. 18. D. 16.
tham khảo:
12C: 16O16O; 17O17O; 18O18O; 16O17O; 16O18O; 17O18O → 6 phân tử CO2 từ đồng vị 12C và 3 đồng vị O
Tương tự cũng có 6 phân tử CO2 từ đồng vị 13C và 3 đồng vị O.
Tổng số tạo thành tối đa 12 phân tử CO2
Đáp án A
Nguyên tố O có 3 đồng vị 16O, 17O, 18O. Biết 752,875. 1020 nguyên tử oxi có khối lượng m gam. Tỷ lệ giữa các đồng vị lần lượt là 16O : 17O = 4504 : 301, 18 O : 17O = 585 : 903 . Tính giá trị của m
A. 2,0175
B. 2,0173
C. 2, 0875
D. 2,0189
Đáp án B
• 16O : 17O = 4504 : 301; 18O : 17O = 585 : 903 = 195 : 301
→ 16O : 17O : 18O = 4504 : 301 : 195
Phần trăm từng đồng vị của O là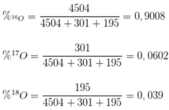
Khối lượng trung bình nguyên tử O là:
MO = 16 x 0,9008 + 17 x 0,0602 + 18 x 0,039 = 16,1382
nO = 752,875. 1020 : (1,6023. 1023) = 0,125 mol
→ mO = 0,125 x 16,1382 = 2,017275 gam
Trong tự nhiên Oxi có 3 đồng vị 16O (x1%) , 17O (x2%) , 18O (4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là:
A. 35% và 61%
B. 90% và 6%
C. 80% và 16%
D. 25% và 71%
Đáp án B
Ta có :
x1 + x2 + 4 = 100
A ¯ = 16 x 1 + 17 x 2 + 18 . 4 100 = 16 , 14
Vậy x1 = 90, x2 = 6
Trong tự nhiên Oxi có 3 đồng vị 16O(x1%) , 17O(x2%) , 18O(4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là
A. 35% & 61%
B. 90% & 6%
C. 80% & 16%
D. 25% & 71%
Đáp án B
Luôn có x1 + x2 + 4 = 100 (1)
Nguyên tử khối trung bình của O là
16 , 4 = ( 16 x 1 + 17 x 2 + 18 . 4 ) / 100 (2)
Từ (1) và (2) => x 1 = 90 ; x 2 = 6