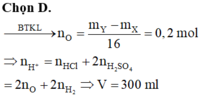Những câu hỏi liên quan
Hòa tan 32 gam hỗn hợp X (Fe, Mg, Al, Zn ) bằng dung dịch HCl dư thu được 2,24 lít H2 (đktc). Mặt khác, cho 32 gam X tác dụng với H2SO4 đặc nóng dư thu được 3,36 lít SO2 (đktc ). Tính %mFe?
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\\n_{Zn}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BT e, có: 2nFe + 2nMg + 3nAl + 2nZn = 2nH2
⇒ 2a + 2b + 3c + 2d = 0,2 (1)
Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BT e, có: 3nFe + 2nMg + 3nAl + 2nZn = 2nSO2
⇒ 3a + 2b + 3c + 2d = 0,3 (2)
Trừ 2 vế của (2) và (1), được: a = 0,1 (mol)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1.56}{32}.100\%=17,5\%\)
Đúng 3
Bình luận (0)
Cho 14,5 gam hỗn hợp X (Fe, Mg, Zn) tác dụng với oxi, thu được 17,7 gam hỗn hợp Y gồm các oxit và kim loại dư. Biết Y tan vừa đủ trong V (ml) dung dịch hỗn hợp gồm HCl 1M và H2SO4 0,5M tạo ra 2,24 lít khí H2 (đktc). Giá trị của V là A. 250 B. 150 C. 200 D. 300
Đọc tiếp
Cho 14,5 gam hỗn hợp X (Fe, Mg, Zn) tác dụng với oxi, thu được 17,7 gam hỗn hợp Y gồm các oxit và kim loại dư. Biết Y tan vừa đủ trong V (ml) dung dịch hỗn hợp gồm HCl 1M và H2SO4 0,5M tạo ra 2,24 lít khí H2 (đktc). Giá trị của V là
A. 250
B. 150
C. 200
D. 300
Cho 12,45 gam hỗn hợp Mg, Zn, Fe tác dụng hết với dung dịch HCl thấy thoát ra 6,72 lít H2 (đktc). Tính khối lượng muối tạo thành?
A. 33 gam
B. 33,75 gam
C. 34 gam
D. 33,50 gam
Đáp án B.
Số mol của Hiđro bằng:
n H 2 = 6 , 72 22 , 4 = 0 , 3 ( m o l )
lại có n C l - t r o n g m u ố i = 2 n H 2 = 2 . 0 , 3 = 0 , 6
Khối lượng muối tạo thành bằng: 12,45 + 0,6. 35,5 = 33,75 (gam).
Đúng 0
Bình luận (0)
Cho 4,45 gam hỗn hợp bột Zn, Mg tác dụng với dung dịch HCl dư thấy có 2,24 lít khí H2 bay ra (đktc). Khối lượng Zn trong hỗn hợp là:
A. 3,25
B. 4
C. 1,2
D. 1,625
Đáp án A.
Gọi nZn = a , nMg = b (mol)
Zn + 2HCl→ ZnCl2 + H2
a → a (mol)
Mg + 2HCl→ MgCl2 + H2
b b (mol)
Ta có: 65a + 24b = 4,45
a + b = 0,1
Giải ra ta có a = b = 0,05
mZn = 0,05.65 = 3,25 (g)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 15.3g hỗn hợp X gồm Mg Al Zn vào dd HCl dư thu được 4.48l H2 (đktc). mặt khác, neus cho 15.3g hỗn hợp X tác dụng với khí Cl2 dư thì thu được m gam muối khan. Tính m
Câu 5. Cho 25,55g hỗn hợp gồm Fe và Zn tác dụng vừa đủ với dung dịch HCl 2M thu được 8,96 lít H2 (đktc).
a) Tìm % khối lượng của Fe và Zn có trong hỗn hợp ban đầu.
b) Tính thể tích dung dịch HCl 2M cần dùng.
c) Tính CM của mỗi muối tạo thành sau phản ứng. (Giả sử thể tích không đổi)
a.\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{8,96}{22,4}=0,4mol\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_{Zn}=y\end{matrix}\right.\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
x x ( mol )
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}56x+65y=25,55\\x+y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,35\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,05.56=2,8g\)
\(\Rightarrow m_{Zn}=0,35.65=22,75g\)
\(\%m_{Fe}=\dfrac{2,8}{25,55}.100=10,95\%\)
\(\%m_{Zn}=100\%-10,95\%=89,05\%\)
b.\(n_{HCl}=2.0,05+2.0,35=0,8mol\)
\(C_M=\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,8}{2}=0,4l\)
Đúng 1
Bình luận (0)
Cho m gam hỗn hợp X gồm các kim loại Al, Mg, Fe, Zn, tác dụng vừa đủ với dung dịch HCl tạo ra 1,456 lít (đktc) H2. Cũng m gam hỗn hợp X tác dụng với khí Cl dư tạo ra (m+4,97) g hỗn hợp các muối. Khối lượng Fe trong m gam X là?
Cho 13,5 gam hỗn hợp X gồm Mg, Al,Fe, Zn tác dụng với một lượng dung dịch chứa HCl (dư) được V(l) khí H2(đktc) và 66,75 (g) hỗn hợp Y gồm MgCl2, AlCl3, FeCl2, ZnCl2. a) Viết PTHH xảy ra? b) Tìm V?
Xem chi tiết
a)
\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ Zn + 2HCl \to ZnCl_2 + H_2\)
b)
Gọi : \(n_{H_2} = a(mol) \Rightarrow n_{HCl} = 2a\)
Bảo toàn khối lượng :
\(13,5 + 2a.36,5 = 66,75 + 2.a\\ \Rightarrow a = 0,75\\ \Rightarrow V = 0,75.22,4 = 16,8(lít)\)
Đúng 2
Bình luận (0)
a) Mg + 2 HCl -> MgCl2 + H2
2Al + 6 HCl -> 2 AlCl3 + 3 H2
Fe + 2 HCl -> FeCl2 + H2
Zn + 2 HCl -> ZnCl2 + H2
b) mY-mX=mCl
<=> mCl= 66,75-13,5=53,25(g)
=>nCl=53,25/35,5=1,5(mol)
=> nH2= nCl/2= 1,5/2=0,75(mol)
=>V=V(H2,đktc)=0,75.22,4=16,8(l)
Đúng 2
Bình luận (0)
Cho 6 gam hỗn hợp X gồm Al , Fe, Zn , Mg ( trong đó Fe chiếm a% về khối lượng ) tác dụng với dd HCl dư thu được 1,85925 l khí H2 (đktc) . Nếu cho 6 g hỗn hợp X tác dụng hết với Cl2 dư thì thu được 12,39 g hỗn hợp muối . Tìm a
Mọi người giúp mình với ạ:((
Coi hỗn hợp X gồm R ( có hoá trị n - a mol) và Fe (b mol)
$\Rightarrow Ra + 56b = 6$
$2R + 2nHCl \to 2RCl_n + nH_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 0,5an + b = \dfrac{1,85925}{22,4} = 0,083(mol)(1)$
$2R + nCl_2 \xrightarrow{t^o} 2RCl_n$
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$m_{Cl_2} = m_{muối} - m_X = 12,39 - 6 = 6,39(gam)$
$n_{Cl_2} = 0,5an + 1,5b = 0,09(2)$
Từ (1)(2) suy ra : an = 0,138 ; b = 0,014
$\%m_{Fe} = a\% = \dfrac{0,014.56}{6}.100\% = 13,07\%$
Đúng 2
Bình luận (1)