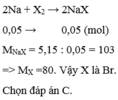Cho 3,9 gam K tác dụng với halogen X thu được 5,8 gam muối. Xác định tên halogen X.

Những câu hỏi liên quan
Bài 1: Cho 7,14 gam muối kali của 1 halogen tác dụng với dung dịch AgNO3 thu được 11,28 gam kết tủa. Xác định tên halogen?
\(CT:KX\)
\(KX+AgNO_3\rightarrow AgX+KNO_3\)
\(39+X...........108+X\)
\(7.14.......................11.28\)
\(\Leftrightarrow11.28\cdot\left(39+X\right)=7.14\cdot\left(108+X\right)\)
\(\Leftrightarrow X=80\)
\(X:Brom\)
Đúng 2
Bình luận (0)
Câu 1: Cho 42,6 g muối natri của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 85,1 g hỗn hợp muối kết tủa. Xác định tên 2 muối halogen. Tính % khối lượng 2 muối trong hỗn hợp ban đầu.Câu 2: Cho 75,9 g muối kali của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 127,65 g kết tủa. Xác định tên 2 muối halogen. Tính % m 2 muối halogen.Câu 3: Cho 31,1 g hỗn hợp 2 halogen liên tiếp tác dụng vừa đủ với m gam Ba, thu được 65,35 g muối. Xác định tên 2 halogen. Tí...
Đọc tiếp
Câu 1: Cho 42,6 g muối natri của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 85,1 g hỗn hợp muối kết tủa. Xác định tên 2 muối halogen. Tính % khối lượng 2 muối trong hỗn hợp ban đầu.
Câu 2: Cho 75,9 g muối kali của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 127,65 g kết tủa. Xác định tên 2 muối halogen. Tính % m 2 muối halogen.
Câu 3: Cho 31,1 g hỗn hợp 2 halogen liên tiếp tác dụng vừa đủ với m gam Ba, thu được 65,35 g muối. Xác định tên 2 halogen. Tính %m 2 halogen
Câu 4: Cho 5,4 g Al phản ứng vừa đủ với 34,65 g hỗn hợp 2 halogen liên tiếp. Xác định tên 2 halogen? Tính %m 2 muối halogen
CHO 3,87 GAM HỖM HỢP MUỐI NATRI CỦA 2 HALOGEN LIÊN TIẾP TÁC DỤNG VỚI DD AgNO3 DƯ THU ĐƯỢC 6,63 GAM KẾT TỦA . XÁC ĐỊNH TÊN 2 HALOGEN KẾ TIẾP
Chia làm 2 trường hơp:
TH1: Giả sử cả 2 halogen đều tạo kết tủa với bạc.
Gọi công thức trung bình của 2 halogen là NaX:
NaX + AgNO3 ---> AgX (kết tủa) + NaNO3
3,87 170x 6,63 85x
Áp dụng định luật bảo toàn khối lượng ta có: 3,87 + 170x = 6,63 + 85x
Suy ra số mol phản ứng: x = 0,03247 mol.
Nguyên tử khối trung bình của 2 halogen là: X = 3,87/0,03247 - 23 = 96,18.
Như vậy 2 halogen cần tìm là Brom (80) và Iot (127).
TH2: Giả sử chỉ có 1 halogen tạo kết tủa với bạc, halogen còn lại không tạo kết tủa với bạc là Flo.
Vì 2 halogen liên tiếp nên halogen còn lại là Clo.
NaCl + AgNO3 ---> AgCl + NaNO3
nNaCl = nAgCl = 6,63/143,5 = 0,0462 mol.
mNaCl = 0,0462.58,5 = 2,7 g.
mNaF = 3,87 - 2,7 = 1,17 g.
Đúng 0
Bình luận (2)
Cho 0,24 gam kim loại Mg tác dụng vừa đủ với khí Halogen X2,sau phản ứng thu được 1,84 gam muối khan.Xác định công thức và tên của muối Halogen thu được?
Xem chi tiết
PTHH: \(Mg+X_2\rightarrow MgX_2\)
Ta có: \(\dfrac{0,24}{24}=\dfrac{1,84}{24+2\cdot M_X}\) \(\Rightarrow M_X=80\)
Vậy Halogen cần tìm là Brom
Muối thu được là Magie Bromua
Đúng 2
Bình luận (0)
Cho 1,15 gam Na tác dụng vừa đủ với halogen X 2 thu được 5,15 gam muối. Nguyên tố halogen X là
A. Flo.
B. Clo.
C. Brom.
D. Iot.
. Cho 5,4 gam nhôm tác dụng vừa đủ với 200 gam dung dịch axit HX 10,95% (X là halogen) thu được V lít khí ở đktc. Xác định halogen, tính V?
\(m_{HX}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HX --> 2AlX3 + 3H2
0,2--->0,6-------------->0,3
=> \(M_{HX}=\dfrac{21,9}{0,6}=36,5\left(g/mol\right)\)
=> X là Cl
VH2 = 0,3.22,4 = 6,72(l)
Đúng 5
Bình luận (0)
Cho m gam một đơn chất halogen (X2) tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam X2 tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen X2 là A. F2 B. Cl2 C. Br2 D. I
Đọc tiếp
Cho m gam một đơn chất halogen (X2) tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam X2 tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen X2 là
A. F2
B. Cl2
C. Br2
D. I
Đáp án B
Mg + X2 → MgX2
2Al + 3X2→ 2AlX3
Bảo toàn nguyên tố X:
2nMgX2 = 3nAlX3 => 2.9,5/(24 + 2X) = 3.8,9/(27 + 31X) => X = 35,5 (Cl)
Đúng 0
Bình luận (0)
Cho m gam một đơn chất halogen (
X
2
) tác dụng hết với magie thì thu được 19 gam muối. Mặt khác cho m gam
X
2
tác dụng hết với nhôm thì thu được 17,8 gam muối. Đơn chất halogen
X
2
là A.
F
2
B.
C
l
2
C.
B
r...
Đọc tiếp
Cho m gam một đơn chất halogen ( X 2 ) tác dụng hết với magie thì thu được 19 gam muối. Mặt khác cho m gam X 2 tác dụng hết với nhôm thì thu được 17,8 gam muối. Đơn chất halogen X 2 là
A. F 2
B. C l 2
C. B r 2
D. I 2
Chọn đáp án B
Bảo toàn nguyên tố X:
2 n M g X 2 = 3 n A l X 3
2 . 19 24 + 2 X = 3 . 17 , 8 27 + 3 X
=> X = 35,5 (Cl)
Đúng 0
Bình luận (0)
Cho m gam một đơn chất halogen
X
2
tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam
X
2
tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen
X
2
là A.
F
2
B.
C
l
2
C.
B...
Đọc tiếp
Cho m gam một đơn chất halogen X 2 tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam X 2 tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen X 2 là
A. F 2
B. C l 2
C. B r 2
D. I 2
Chọn đáp án B
Bảo toàn nguyên tố X:
2 n M g X 2 = 3 n A l X 3
=> 2 9 , 24 + 2 X = 3 8 , 9 27 + 31 X
=> X = 35,5 (Cl)
Đúng 0
Bình luận (0)