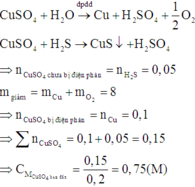8. Tính khối lượng AgNO3 cần dùng để kết tủa hết ion clorua trong 50ml dung dịch
NaCl 0,5M

Những câu hỏi liên quan
Sau một thời gian điện phân 200ml dung dịch CuSO4 với điện cực graphit, khối lượng của dung dịch giảm 8g. Để làm kết tủa hết ion Cu2+ trong dd còn lại sau điện phân, cần dùng 100ml dung dịch H2S 0,5M. Nồng độ mol của dung dịch CuSO4 trước khi điện phân là A. 0,5M B. 0,75M C. 1M D. 1,5M
Đọc tiếp
Sau một thời gian điện phân 200ml dung dịch CuSO4 với điện cực graphit, khối lượng của dung dịch giảm 8g. Để làm kết tủa hết ion Cu2+ trong dd còn lại sau điện phân, cần dùng 100ml dung dịch H2S 0,5M. Nồng độ mol của dung dịch CuSO4 trước khi điện phân là
A. 0,5M
B. 0,75M
C. 1M
D. 1,5M
Cho 200 ml dung dịch HCl 0,5M phản ứng hoàn toàn với dung dịch AgNO3 6,8%, sau phản ứng thu được dung dịch A và kết tủa B.
Viết phương trình hóa học xảy ra.
Tính khối lượng kết tủa B thu được.
Tính khối lượng dung dịch AgNO3 6,8% đã dùng.
Cho 1,2 gam một kim loại X có hóa trị II tác dụng vừa đủ với cùng lượng axit HCl trên. Xác định tên kim loại X.
Xem chi tiết
a)PTHH: AgNO3 + HCl → AgCl↓ + HNO3
nHCl = 0,2.0,5 = 0,1 mol
=> nAgCl = 0,1 mol = nAgNO3 = 0,1 mol = nHCl phản ứng
<=> mAgCl = 0,1.143,5 = 14,35 gam
mAgNO3 = 0,1.170 = 17 gam
=> mdd AgNO3 = \(\dfrac{17}{6,8\%}\)= 250 gam
b) X + 2HCl --> XCl2 + H2
1,2 gam X tác dụng vừa đủ với 0,1 mol HCl
=> Số mol của 1,2 gam X = 0,05 mol
<=> Mx = \(\dfrac{1,2}{0,05}\)= 24 (g/mol) => X là magie ( Mg )
Đúng 0
Bình luận (0)
Dung dịch A chứa các ion Cu2+, Fe3+, Cl-. Để kết tủa hết ion Cl- trong 10ml dung dịch A phải dùng hết 70ml dung dịch AgNO3 1M. Cô cạn 100ml dung dịch A thu được 43,25g hỗn hợp muối khan. Tính nồng độ mol các ion Cu2+, Fe3+, Cl- A. 2M; 1M; 7M B. 2M; 1M; 0,7M C. 0,2M; 0,1M; 7M D. 0,2M; 0,1M; 0,7M
Đọc tiếp
Dung dịch A chứa các ion Cu2+, Fe3+, Cl-. Để kết tủa hết ion Cl- trong 10ml dung dịch A phải dùng hết 70ml dung dịch AgNO3 1M. Cô cạn 100ml dung dịch A thu được 43,25g hỗn hợp muối khan. Tính nồng độ mol các ion Cu2+, Fe3+, Cl-
A. 2M; 1M; 7M
B. 2M; 1M; 0,7M
C. 0,2M; 0,1M; 7M
D. 0,2M; 0,1M; 0,7M
Đáp án A
Ag++ Cl- →AgCl
nCl- = nAg+ = 0,07 mol (trong 10 ml A)
Gọi số mol Cu2+; Fe3+ có trong 100 ml A là x, y mol
Theo ĐLBT ĐT thì: 2x+ 3y = 0,7
64x+ 56y+ 0,7.35,5 = 43,25 gam
Suy ra x = 0,2; y = 0,1
Suy ra nồng độ mol các ion Cu2+,Fe3+,Cl- lần lượt là 2M; 1M; 7M
Đúng 0
Bình luận (0)
Bài 4: Người ta hòa tan 80,5 gam ZnSO4 vào nước để được 1500 ml dung dịch.a. Tính nồng độ mol của ZnSO4 và của các ion có trong dung dịch.b. Tính thể tích dung dịch Na2S 0,5M cần làm kết tủa hết ion Zn2+ .c. Tính thể tích dung dịch BaCl2 0,8M cần để làm kết tủa hết ion SO4^{2-} .(khỏi cần làm câu a cũng được ạ , chủ yếu là làm câu b và c chi tiết một chút )
Đọc tiếp
Bài 4: Người ta hòa tan 80,5 gam ZnSO4 vào nước để được 1500 ml dung dịch.
a. Tính nồng độ mol của ZnSO4 và của các ion có trong dung dịch.
b. Tính thể tích dung dịch Na2S 0,5M cần làm kết tủa hết ion Zn2+ .
c. Tính thể tích dung dịch BaCl2 0,8M cần để làm kết tủa hết ion SO4\(^{2-}\) .
(khỏi cần làm câu a cũng được ạ , chủ yếu là làm câu b và c chi tiết một chút )
Muốn hợp tác giúp đỡ nhau thì liên hệ Fb:Quang Tâm(Sun).
Đúng 1
Bình luận (0)
Đề: Cho 50ml dd AgNO3 có nồng độ 2 mol tác dụng với 36,5g dd axitclohiđric. Sau phản ứng người ta dùng 4g Natrihiđroxit để trứng hoà hết lượng axitclohiđric dư a) Tính khối lượng chất kết tủa tạo thành? b) Tính nồng độ % của dd axitclohiđric đã sử dụng bàn đầu? Giúp mik vs ạ, mai mik thi rồi 😰
a)
$AgNO_3 + HCl \to AgCl + H_2O$
$NaOH + HCl \to NaCl + H_2O$
$n_{AgCl} = n_{AgNO_3} = 0,05.2 = 0,1(mol)$
$n_{AgCl} = 0,1.143,5 = 14,35(gam)$
b) $n_{HCl\ dư} = n_{NaOH} = 0,1(mol) ; n_{HCl\ pư} = n_{AgNO_3} = 0,1(mol)$
$\Rightarrow n_{HCl\ đã\ dùng} = 0,2(mol)$
$C\%_{HCl} = \dfrac{0,2.36,5}{36,5}.100\% = 20\%$
Đúng 1
Bình luận (0)
Hòa tan 3,93 gam hỗn hợp MgCl2 và KCl thành 500 ml dung dịch A. Để làm kết tủa 25ml dung dịch A cần dùng 60ml dung dịch AgNO3 0,05 M. Tính khối lượng mỗi muối trong hỗn hợp?
Hòa tan 3,93 gam hỗn hợp MgCl2 và KCl thành 500 ml dung dịch A. Để làm kết tủa 25ml dung dịch A cần dùng 60ml dung dịch AgNO3 0,05 M. Tính khối lượng mỗi muối trong hỗn hợp?
gọi a là số mol mgcl2
blaf số mol kcl
=> 95a +74,5b =3,93 (g) (1)
cl- + ag+ => agcl
nag+ =0,07mol
=>ncl- =0,07 mol
=>2a +b =0,07 (2)
từ 1 và 2 ta có
\(\left\{{}\begin{matrix}95a+74,5b=3,93\\2a+b=0,07\end{matrix}\right.\) =>\(\left\{{}\begin{matrix}a=\dfrac{257}{10800}\\b=\dfrac{121}{5400}\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hòa tan 5,94 gam hỗn hợp 2 muối clorua của 2 kim loại A, B (đều có hoá trị II) vào nước được dung dịch X. Để làm kết tủa hết ion Cl- có trong dung dịch X người ta cho dung dịch X tác dụng với dung dịch AgNO3 thu được 17,22 gam kết tủa. Xác định công thức hóa học của 2 muối chloride
Đọc tiếp
Hòa tan 5,94 gam hỗn hợp 2 muối clorua của 2 kim loại A, B (đều có hoá trị II) vào nước được dung dịch X. Để làm kết tủa hết ion Cl- có trong dung dịch X người ta cho dung dịch X tác dụng với dung dịch AgNO3 thu được 17,22 gam kết tủa. Xác định công thức hóa học của 2 muối chloride
trộn 50ml dung dịch có chứa 11,7g nacl với 150ml dung dịch có chứa 25,5g agno3
a tính khối lượng kết tủa tạo thành
b tính Cm trong dung dịch phản ứng ( voi thể tích dung dịch ko đáng kể)
50ml = 0,05l
150ml =0,15l
\(n_{NaCl}=\dfrac{11,7}{58,5}=0,2\left(mol\right)\)
\(n_{AgNO3}=\dfrac{25,5}{170}=0,15\left(mol\right)\)
Pt : \(NaCl+AgNO_3\rightarrow NaNO_3+AgCl|\)
1 1 1 1
0,2 0,15 0,15 0,15
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\)
⇒ NaCl dư , AgNO3 phản ứng hết
⇒ Tính toán dựa vào số mol của AgNO3
\(n_{AgCl}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{AgCl}=0,15.143,5=21,525\left(g\right)\)
b) \(n_{NaNO3}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(n_{NaCl\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)
\(V_{ddspu}=0,05+0,15=0,2\left(l\right)\)
\(C_{M_{NaNO3}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
\(C_{M_{NaCl\left(dư\right)}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)