Trong phòng thí nghiệm thí khí CO2 được điều chế bằng phương trình phản ứng
![]()
![]()
![]()
![]()
a) Trình bày thí nghiệm điều chế H2 trong phòng thí nghiệm. Viết phương trình phản ứng (nếu có)?
b) Trình bày thí nghiệm điều chế O2 trong phòng thí nghiệm. Viết phương trình phản ứng (nếu có)?
a. – Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
– Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
b. – Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao.
2KMnO4 ---t° → K2MnO4 + MnO2 + O2
2KClO3 ---t° → 2KCl + 3O2
– Khí O2 ít tan trong nước và nặng hơn không khí nên ta có thể thu O2 theo 2 cách: Đẩy nước và đẩy không khí.
Trong phòng thí nghiệm có các hóa chất KClO3 , MnO2 và dụng cụ cần thiết
a, Viết phương trình hóa học của phản ứng điều chế khí oxi
b, Hãy vẽ hình mô tả thí nghiệm điều chế và thu khí oxi bằng cách đẩy không khí
a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK
câu 9 : trong phòng thí nghiệm điều chế khí oxi bằng cách nhiệt phân muối kaliclorat
a) viết phương trình phản ứng
b) muốn điều chế 4,48 gam khí oxi (đktc) cần dùng bao nhiêu gam KCLO3 sau phản ứng thu được bao nhiêu gam chất rắn
a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
Trong phòng thí nghiệm, khí CO được điều chế bằng phản ứng
A. 2C + O2 → t ∘ 2CO2
B. C + H2O → t ∘ CO + H2
C. HCOOH → H 2 S O 4 , t ∘ CO + H2O
D. 2CH4 + 3O2 → t ∘ 2CO + 4H2O
Chọn C
HCOOH → H 2 S O 4 , t ∘ CO + H2O
Trong phòng thí nghiệm ngươi ta điều chế khí H2 bằng cách cho kim loại
nhôm tác dụng với dung dịch axitClohidric (HCl) Sau phản ứng thu được muối nhôm cloru
(AlCl3) và 4 48 lít khí hidro điều kiện tiêu chuẩn
Hãy viết phương trình phản ứng xảy ra
b Tính hối lượng kim loại nhôm thu được sau phản ứng
c. Tính hối lượng muối thu được sau phản ứng .
(Biết H = 1, Cu = 64, O =16, Fe = 56, Cl = 35,5, Al = 27)
giúp mik với ạaa
2Al + 6HCL → 2AlCl3 + 3H2
b) nH2 = 4,48 : 22,4= 0,2 mol => nAl = nAlCl3 = 0,2 : 3 . 2 = \(\dfrac{2}{15}\) mol
mAl = \(\dfrac{2}{15}\).27=3.6 g
mAlCl3 = \(\dfrac{2}{15}\)(27+35,5.3) = 17,8 g
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
_____2/15___________2/15____0,2 (mol)
b, \(m_{Al}=\dfrac{2}{15}.27=3,6\left(g\right)\)
c, \(m_{AlCl_3}=\dfrac{2}{15}.133,5=17,8\left(g\right)\)
Bạn tham khảo nhé!
Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy không khí như hình vẽ.
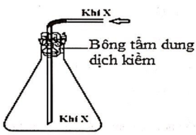
Khí X tạo ra từ phuơng trình phản ứng:
A. Ca(OH)2 dung dịch + 2NH4Cl rắn → 2NH3 + CaCl2 2H2O.
B. MnO2 + 4HCl đặc → MnCl2 + Cl2 + 2H2O.
C. CaC2 + 2H2O → Ca(OH)2 + C2H2.
D. Zn + 2HCl (dung dịch) → ZnCl2 + H2
Viết phương trình phản ứng điều chế hidro trong phòng thí nghiệm.
Điều chế hidro trong phòng thí nghiệm:
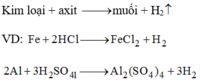
Viết phương trình phản ứng minh họa :
a) Trong phòng thí nghiệm khí oxi được điều chế bằng cách nung nóng kaliclorat
b) Hòa tan điphotpho pentaoxit vào nước thu được dung dịch axit photphoric
c) Cho bột sắt (III) oxit đi qua khí hidro nung nóng thu được sắt và hơi nước
d) Bỏ mẫu kali vào nước thì thấy sủi bọt khí không màu
\(a,2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ b,P_2O_5+3H_2O\rightarrow2H_3PO_4\\ c,Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ c,2K+2H_2O\rightarrow2KOH+H_2\)
a)\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
b)\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
c)\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
d)\(2K+2H_2O\rightarrow2KOH+H_2\uparrow\)
Điều chế khí CO trong phòng thí nghiệm bằng phản ứng nào
A. HCOOH → H 2 S O 4 Đ CO + H2O
B. 2C + O2 → t o 2CO
C. C + H2O ⇌ 1050 o C CO + H2
D. CO2 + C → t o 2CO
Trong phòng thí nghiệm, CO được điều chế bằng cách cho H 2 S O 4 đặc vào HCOOH và đun nóng
H C O O H + H 2 S O 4 → C O + H 2 O
Đáp án A