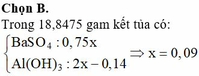Cho 300 ml dung dịch B a O H 2 0,1M vào 400 ml dung dịch N a H C O 3 0,1M thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 100
B. 120
C. 60
D. 90