Khi thêm một ít dung dịch HCl vào dung dịch CH 3 COOH thì nồng độ ion CH 3 COO - trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
A. Tăng
B. Giảm
C. Không đổi.
D. Tăng sau đó giảm
a, \(CH_3COOH⇌CH_3COO^-+H^+\)
Bđ: 0,1 0 0 (M)
Pư: x x x (M)
Cb: 0,1-x x x (M)
Có: \(K_c=\dfrac{\left[CH_3COO^-\right]\left[H^+\right]}{\left[CH_3COOH\right]}\Rightarrow1,8.10^{-5}=\dfrac{x.x}{0,1-x}\) \(\Rightarrow x\approx1,33.10^{-3}\)
⇒ pH = -log[H+] = 2,88
b, \(CH_3COONa⇌CH_3COO^-+Na^+\)
\(CH_3COO^-+H_2O⇌CH_3COOH+OH^-\)
→ MT base
c, \(n_{NaOH}=0,01.0,1=0,001\left(mol\right)\)
\(n_{CH_3COOH}=0,01.0,2=0,002\left(mol\right)\)
PT: \(NaOH+CH_3COOH\rightarrow CH_3COONa+H_2O\)
Xét tỉ lệ: \(\dfrac{0,001}{1}< \dfrac{0,002}{1}\), ta được CH3COOH dư.
Theo PT: \(n_{CH_3COOH\left(pư\right)}=n_{CH_3COONa}=n_{NaOH}=0,001\left(mol\right)\)
\(\Rightarrow n_{CH_3COOH\left(dư\right)}=0,002-0,001=0,001\left(mol\right)\)
→ Dd A gồm: CH3COONa: \(\dfrac{0,001}{0,02}=0,05\left(M\right)\) và CH3COOH: \(\dfrac{0,001}{0,02}=0,05\left(M\right)\)
\(CH_3COOH⇌CH_3COO^-+H^+\)
Bđ: 0,05 0,05 0 (M)
Pư: x x+0,05 x (M)
Cb: 0,05-x x+0,05 x (M)
\(\Rightarrow\dfrac{x\left(x+0,05\right)}{0,05-x}=1,8.10^{-5}\Rightarrow x\approx1,8.10^{-5}\)
⇒ pH = 4,74
Giải thích vì sao dung dịch HCl dẫn diện tốt hơn dung dịch CH3COOH có cùng nồng độ.
\(HCl\xrightarrow[]{}H^++Cl^-\)
\(CH_3COOH⇌H^++CH_3COO^-\)
HCl là chất điện li mạnh, CH3COOH là chất điện li yếu nên nếu 2 acid này cùng nồng độ thì HCl tạo ra nhiều ion hơn. Do vậy đương nhiên HCl dẫn điện tốt hơn.
Tính nồng độ mol/l của các ion trong các trường hợp sau :
a/ Dung dịch CH3COOH 0,01M , độ điện li \(\alpha=4,25\%\)
b/ Dung dịch CH3COOH 0,1M , độ điện li \(\alpha=1,34\%\)
c/ Dung dịch CH3COOH 0,1M . Cho Ka = 1,8 .10-5
HELP ME !!!!!!
1.Cho 7,2 g Mg vào 120 g dung dịch CH3COOH 20%. Tính nồng độ % của dung dịch thu được
2.Cho 120 g dung dịch CH3COOH 15% vào 100g dung dịch NaOH 20%. Tính nồng độ % của dung dịch thu được.
3.Cho 14g vôi sống (CaO) vào 200 g dung dịch CH3COOH 18%. Tính nồng độ % của dung dịch thu được.
4.Trộn lẫn 42,4g dung dịch Na2CO3 10% vào dung dịch CH3COOH 5% thu được 0,448 lít khí(đktc)
Tính khối lượng dung dịch axit cần dùng Tính nồng độ % của dung dịch thu được sau phản ứng.1.
\(PTHH:2CH_3COOH+Mg\rightarrow\left(CH_3COO\right)_2Mg+H_2\)
\(n_{Mg}=\frac{7,2}{24}=0,3\left(mol\right)\)
\(m_{CH3COOH}=\frac{120.20}{100}=24\left(g\right)\Rightarrow n_{CH3COOH}=0,4\left(mol\right)\)
Theo PT:
\(n_{\left(CH3COO\right)2Mg}=\frac{1}{2}n_{CH3COOH}=0,2\left(mol\right)\)
\(\Rightarrow m_{\left(CH3COO\right)2Mg}=28,4\left(g\right)\)
\(\Rightarrow m_{dd_{spu}}=7,2+120-0,4=126,8\left(g\right)\)
\(\Rightarrow C\%_{CH3COOMg}=22,3\%\)
2.
\(PTHH:CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
Ta có :
\(m_{CH3COH}=\frac{15.120}{100}=18\left(g\right)\Rightarrow n_{CH3COOH}=0,3\left(mol\right)\)
\(m_{NaOH}=\frac{20.100}{100}=20g\left(g\right)\)
\(\Rightarrow n_{NaOH}=0,5\left(mol\right)\)
Theo PT thì NaOH dư
\(n_{CH3COONa}=n_{CH3COOH}=0,3\left(mol\right)\)
\(\Rightarrow m_{CH3COONa}=24,6\left(g\right)\)
\(m_{dd\left(spu\right)}=120+100=220\left(g\right)\)
\(\Rightarrow C\%_{CH3COONa}=11,2\%\)
3.
\(n_{CaO}=\frac{14}{56}=0,25\left(mol\right)\)
\(m_{CH3COOH}=\frac{200.18}{100}=36\left(g\right)\)
\(\Rightarrow n_{CH3COOH}=\frac{36}{60}=0,6\left(mol\right)\)
\(PTHH:2CH_3COOH+CaO\rightarrow\left(CH_3COO\right)_2Ca+H_2O\)
Lập tỉ lệ: \(\frac{0,25}{1}< \frac{0,6}{2}\)
\(\Rightarrow\) CaO hết. CH3COOH dư
\(n_{CH3COOH_{dư}}=0,6-0,25.2=0,1\left(mol\right)\)
\(m_{dd\left(thu.duoc\right)}=14+200=214\left(g\right)\)
\(C\%_{\left(CH3COO\right)2Na}=\frac{0,25.158}{214}.100\%=18,46\%\)
\(C\%_{CH3COOH_{dư}}=\frac{0,1.60}{214}.100\%=2,8\%\)
4.
\(m_{Na2CO3}=\frac{42,4.10}{100}=4,24\left(g\right)\)
\(n_{Na2CO3}=\frac{4,24}{106}=0,04\left(mol\right)\)
\(n_{CO2}=\frac{0,448}{22,4}=0,02\left(mol\right)\)
\(PTHH:2CH_2COOH+Na_2CO_3\rightarrow2CH_3COONa+H_2O+CO_2\)
_______0,04 ___________ 0,02 ____________ 0,04 __________ 0,02
Sau phản ứng Na2CO3 dư.
\(n_{Na2CO3_{dư}}=0,04-0,02=0,02\left(mol\right)\)
\(m_{dd\left(CH3COOH\right)}=\frac{2,4.100}{5}.100\%=48\left(g\right)\)
\(m_{dd\left(Spu\right)}=m_{dd\left(Na2CO3\right)}+m_{dd_{Axit}}-m_{CO2}\)
\(=42,4+48-0,02.44=89,52\left(g\right)\)
\(m_{CH3COOH}=0,04.60=2,4\left(g\right)\)
\(C\%_{Na2CO3\left(dư\right)}=\frac{0,02.106}{89,52}.100\%=2,37\%\)
\(C\%_{CH3COONa}=\frac{0,04.82}{89,52}.100\%=3,66\%\)
Trong một cốc thuỷ tinh đựng dung dịch ZnSO4. Thêm vào cốc 200ml dung dịch KOH nồng độ x mol/l thì thu được 4,95 gam kết tủa. Tách kết tủa, nhỏ dung dịch HCl vào nước lọc thì thấy xuất hiện kết tủa trở lại, tiếp tục cho HCl vào đến khi kết tủa tan hết rồi cho dung dịch BaCl2 dư vào thì thu được 46,6 gam kết tủa. Nồng độ x là
A. 2M
B. 0,5M
C. 4M
D. 3,5M
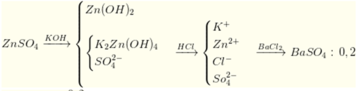
⇒ n Z n S O 4 = 0 , 2 n Z n ( O H ) 2 = 0 , 05 ⇒ n K O H = 0 , 05 . 2 + ( 0 , 2 - 0 , 05 ) 4 = 0 , 7 ⇒ x = 3 , 5
Đáp án D
đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
Đánh giá đúng [H+] < 0,10M vì Axit yếu CH3COOH phân ly không hoàn toàn CH3COOH <=> CH3COO- + H+ [H+] < 0,1 M
đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
Đánh giá đúng \(\left[H+\right]< 0,10M\) vì Axit yếu \(CH_3COOH\) phân ly không hoàn toàn \(CH_3COOH\) \(\Leftrightarrow CH_3COOH-+H+\left[H+\right]< 0,1M\)
đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
vì CH3COOH là chất điện li yếu nên chỉ có một phần phân tử bị hoà tan phần còn lại tồn tại ở dạng phân tử nên nồng độ mol các ion của chất này < 0,10M
đối với dung dịch axit yếu CH3COOH 0,10M , nếu bỏ qua sự điện ly của nước thì ta nên đánh giá nồng độ mol ion của chất này như thế nào là đúng ?
Trong dung dịch axit axetic có cân bằng sau:
CH3COOH\(\overrightarrow{\leftarrow}\)H++CH3COO-
Độ điện li \(\alpha\)của CH3COOH sẽ biến đổi như thế nào khi nhỏ vai giọt dung dịch HCl vào dung dịch axit axetic?
A. Tăng
B. Không biến đổi
C. Giảm
D. Không xác định được