Dung dịch H2SO4 có pH =2 . Lấy 0,2 lít dung dịch này cho tác dụng với 100ml dung dịch Ba(OH)2 có pH =13. Tìm khối lượng kết tủa tối đa thu được:
A. 0,233g
B. 2,33g
C. 23,3g
D. 1,73g
Dung dịch H2SO4 có pH=2 . Lấy 0,2 lít dung dịch này cho tác dụng với 100ml dung dịch Ba(OH)2 có pH=13 . Tìm khối lượng kết tủa tối đa thu được ?
nH+ = 0,01.0,2 =0,002 ⇒ nH2SO4 = 0,001
nOH- = 0,1 . 0,1 = 0,01 ⇒ nBa(OH)2 =0,005
⇒ Ba(OH)2 dư
⇒ nBaSO4 = nH2SO4 = 0,001 ⇒ m↓ = 0,233g
Trộn 100ml dung dịch Ba(OH)2 0,5M và 100ml dung dịch KOH 0,5M thu dung dịch X. Cho X tác dụng với 100ml dung dịch H2SO4 1M. Khối lượng kết tủa và giá trị pH của dung dịch thu được sau phản ứng:
$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)
Cho 200 ml dung dịch hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M phản ứng với x ml dung dịch H2SO4 0,05M thu được (200 + x) ml dung dịch có pH = 13. Sau phản ứng, khối lượng kết tủa tối đa thu được là
A. 1,32 gam
B. 4,66 gam
C. 2,33 gam
D. 1,94 gam
Cho 200ml dung dịch hỗn hợp gồm Ba(OH)2 0,1 M và NaOH 0,1M phản ứng với X ml dung dịch H2SO4 0,5M thu được (200 + x) ml dung dịch có pH = 1. Sau phản ứng khối lượng kết tủa tối đa thu được là
A. 9,32 gam
B. 2,33 gam
C. 12,94 gam
D. 4,66 gam
Cho 200ml dung dịch hỗn hợp gồm Ba(OH)2 0,1 M và NaOH 0,1M phản ứng với X ml dung dịch H2SO4 0,5M thu được (200 + x) ml dung dịch có pH = 1. Sau phản ứng khối lượng kết tủa tối đa thu được là:
A. 9,32 gam.
B. 2,33 gam.
C. 12,94 gam.
D. 4,66 gam.
0,02 mol Ba(OH)2 và 0,02 mol NaOH + 0,0005x mol H2SO4
Dung dịch thu được có pH = 1 => Phản ứng dư axit.
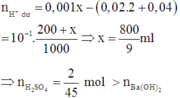
Khối lượng kết tủa BaSO4 tối đa thu được =233.0,02=4,66 gam
=> Chọn đáp án D.
Cho 200ml dung dịch hỗn hợp gồm Ba(OH)2 0,1 M và NaOH 0,1M phản ứng với x ml dung dịch H2SO4 0,5M thu được (200 + x) ml dung dịch có pH = 1. Sau phản ứng khối lượng kết tủa tối đa thu được là
Cho 100ml dung dịch X chứa KOH 0,13M và Ba ( OH ) 2 0,1M tác dụng với 200ml dung dịch H 2 SO 4 x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH = 2. Giá trị của x là
A. 0,03
B. 0,09
C. 0,06
D. 0,045
Chọn B
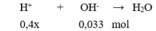
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H + dư
→ 0,4x – 0,033 = 10 - 2 .0,3 → x = 0,09
Cho 250g dung dịch Ba(OH)2 34,2% tác dụng với 150 gam dung dịch H2SO4 4,9%. Tính khối lượng kết tủa thu được
cho 250 g dung dich ba(oh)2 34,2% tác dụng với 150 gam dung dịch h2so4 4,9%
a, tính khối lượng kết tủa thu được
b, tính c% sau phản ứng
Ta có: \(C_{\%_{Ba\left(OH\right)_2}}=\dfrac{m_{Ba\left(OH\right)_2}}{250}.100\%=34,2\%\)
=> \(m_{Ba\left(OH\right)_2}=85,5\left(g\right)\)
=> \(n_{Ba\left(OH\right)_2}=\dfrac{85,5}{171}=0,5\left(mol\right)\)
Ta lại có: \(C_{\%_{H_2SO_4}}=\dfrac{m_{H_2SO_4}}{150}.100\%=4,9\%\)
=> \(m_{H_2SO_4}=7,35\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{7,35}{98}=0,075\left(mol\right)\)
a. PTHH; Ba(OH)2 + H2SO4 ---> BaSO4↓ + 2H2O
Ta thấy: \(\dfrac{0,5}{1}>\dfrac{0,075}{1}\)
Vậy Ba(OH)2 dư.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=0,075\left(mol\right)\)
=> \(m_{BaSO_4}=0,075.233=17,475\left(g\right)\)
b. Ta có: \(m_{dd_{BaSO_4}}=250+7,35=257,35\left(g\right)\)
=> \(C_{\%_{BaSO_4}}=\dfrac{17,475}{257,35}.100\%=6,79\%\)
Câu 8. a. Cho 220ml dung dịch HCl có pH = 5 tác dụng với 180ml dung dịch NaOH có pH = 9 thì thu được dung dịch A. Tính pH của dung dịch A. b. Cho 2,75 lít dung dịch Ba(OH)2 có pH = 13 tác dụng với 2,25 lít
a, \(\left[H^+\right]=10^{-5}\Rightarrow n_{H^+}=0,22.10^{-5}\left(mol\right)\)
\(\left[OH^-\right]=10^{-5}\Rightarrow n_{OH^-}=0,18.10^{-5}\left(mol\right)\)
\(\Rightarrow n_{H^+dư}=0,04.10^{-5}=4.10^{-7}\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{4.10^{-7}}{0,22+0,18}=10^{-8}\)
\(\Rightarrow pH=8\)