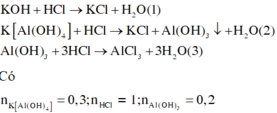Dung dịch M có chứa CuSO 4 và FeSO 4 . Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 2 muối tan. Giải thích mỗi trường hợp bằng phương trình hoá học.

Những câu hỏi liên quan
Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với ?
Nếu cho 11g hỗn hợp Al, Fe tác dụng với 500ml dung dịch CuSO4 ở trên có thấy 64g CuSO4 phản ứng theo sơ đồ sau:
Al+CuSO4------->Al2(SO4)3+Cu Fe+CuSO4-------->Cu+FeSO4
Lập phương trình hóa học. Tính khối lượng của mỗi kim loại trong hỗn hợp đầu
Gọi x,y lần lượt là số mol của Al,Fe
Pt: 2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
..x mol--> \(\frac{3x}{2}\) mol
......Fe + CuSO4 --> FeSO4 + Cu
.y mol--> y mol
\(n_{CuSO_{4}} = \frac{64}{160}= 0,4\) mol
Ta có hệ pt: \(\left\{\begin{matrix} \frac{3x}{2} + y = 0,4& & \\ 27x + 56y = 11 & & \end{matrix}\right.\)
\(\Leftrightarrow \left\{\begin{matrix} x = 0,2 & & \\ y = 0,1 & & \end{matrix}\right.\)
mAl = 0,2 . 27 = 5,4 (g)
mFe = 11 - 5,4 = 5,6 (g)
Đúng 0
Bình luận (0)
Trong phòng học bộ môn hóa học có một cốc thủy tinh hình trụ nặng 100g, bán kính đáy 5cm được đặt trên mặt bàn nằm ngang, đựng 500ml dung dịch CuSO4.
a. Tính áp suất do dung dịch tác dụng lên đáy cốc và áp suất do cốc dung dịch tác dụng lên mặt bàn. Biết ddung dịch CuSO4 1.12g/ml và bỏ qua độ dày của thành cốc. Lấy pi3.14
b. Nếu cho 11g hỗn hợp Al,Fetacs dụng với 500ml dung dịch CuSO4 ở trên thấy có 64g CuSO4 phản ứng theo sơ đồ sau:
Al+CuSO4 rightarrow Al2(SO4)3+Cu
Fe+CuSO4 rightarrow FeS...
Đọc tiếp
Trong phòng học bộ môn hóa học có một cốc thủy tinh hình trụ nặng 100g, bán kính đáy 5cm được đặt trên mặt bàn nằm ngang, đựng 500ml dung dịch CuSO4.
a. Tính áp suất do dung dịch tác dụng lên đáy cốc và áp suất do cốc dung dịch tác dụng lên mặt bàn. Biết ddung dịch CuSO4= 1.12g/ml và bỏ qua độ dày của thành cốc. Lấy pi=3.14
b. Nếu cho 11g hỗn hợp Al,Fetacs dụng với 500ml dung dịch CuSO4 ở trên thấy có 64g CuSO4 phản ứng theo sơ đồ sau:
Al+CuSO4 \(\rightarrow\) Al2(SO4)3+Cu
Fe+CuSO4 \(\rightarrow\) FeSO4+Cu
Có 1 dung dịch chứa 2 muối Al2(SO4)3 và CuSO4 từ dung dịch trên hãy điều chế
a) Dung dịch Al2(SO4)3
b) Dung dịch CuSO4
Viết các PTHH
a) Cho dd trên vào kim loại Zn
b) Cho dd trên vào kim loại Cu
Cho m (g) FeSO4 vào 250 (ml) dung dịch FeSO4 1,2M thu được dung dịch FeSO4 1,5M (khi thêm chất tan, thể tích dung dịch thay đổi không đáng kể)
a) Tính số mol FeSO4 trong cả hai dung dịch trên
b) Tính m
,m(g)FeSO4 :x(mol) vào FeSO4 (0,3 mol) đk: FeSO4 (0,375 mol) Ad: bảo toàn ng tố →x=0,075mol,→m(g)=0,075\(\times\)152=11,4g
Đúng 0
Bình luận (0)
Nêu hiện tượng, viết PTHH:
a) Cho dd HCl vào ống nghiệm chứa Fe 2 O 3
b) Ngâm đinh sắt vào dung dịch CuSO 4
c) Nhỏ dd BaCl 2 vào ống nghiệm chứa dd Na 2 SO 4
d/ Nhỏ dung dịch HCl vào ống nghiệm có chứa mẫu đá vôi
e/ Nhỏ vài giọt dd CuSO 4 vào ống nghiệm chứa dd NaOH
f/ Nung nóng Cu(OH) 2 trên ngọn lửa đèn cồn
a) \(HCl+Fe_2O_3\rightarrow FeCl_3+H_2O\)
b) \(Fe+CuCO_4\rightarrow Cu+FeSO_4\)
c) \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\)
d) \(2HCl+CaCO_3\rightarrow CaCl_2+CO_2+H_2O\)
e) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
f) \(Cu\left(OH\right)_2\rightarrow CuO+H_2O\)
Đúng 0
Bình luận (2)
a) \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
b) \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
c) \(BaCl_2+Na_2SO_4\rightarrow BaSO_4\downarrow+2NaCl\)
d) \(2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+H_2O\)
e) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
f) \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Đúng 0
Bình luận (0)
Nêu hiện tượng và viết PTHH minh họa
a) Cho Na vào dung dịch Al2(So4)3
b) Cho K vào dung dịch FeSo4
c) Hòa tan Fe3O4 vào dung dịch H2SO4 loãng
d) Nung nóng Al với Fe2O3 tạo ra hỗn hợp Al2O3 và FexOy
a. Cho Na vào dd Al2(SO4)3 có hiện tượng sủi bọt khí sau đó tạo kết tủa keo trắng. Pt:
2Na +2H2O ->2NaOH +H2 .
6NaOH +Al2(SO4)3 ->2Al(OH)3 +3Na2SO4.
b. cho K vào dd FeSO4: lúc đầu có khí thoát ra sau đó tạo kết tủa trắng xanh
2K +2H2O ->2KOH +H2.
2KOH +FeSO4 ->Fe(OH)2 (kt) +K2SO4.
c. cho Fe3O4 vào H2SO4 thì chất rắn Fe3O4 tan dần tạo dd màu nâu đỏ nhạt (hh FeSO4 và Fe2(SO4)3
Fe3O4 +4H2SO4 ->FeSO4 +Fe2(SO4)3 +4H2O
d. Cho Al td với Fe2O3, nung nóng thì trên tấm Al xuất hiện bột trắng do Al2O3 tạo thành
2Al +Fe2O3 -to->Al2O3 +2Fe
2xFe +yO2 ->2FexOy
Đúng 0
Bình luận (1)
a, Hiện tượng mà tan xh bọt khí h2 nạ nóng chảy nổi cổ tròn sau đó xh kt keo trắng
b,K tan rã trong dd xh kt màu trắng xanh hóa nâu đỏ ngoài kk . K pứ vs nc trước tạo dd bazơ và xh khí h2
Đúng 0
Bình luận (0)
Dung dịch X chứa m gam KOH và 40,2 gam K[Al(OH)4]. Cho 500 ml dung dịch HCl 2M vào dung dịch X thu được 15,6 gam kết tủa. Giá trị của m là
A. 22,4 hoặc 44,8
B. 12,6
C. 8 hoặc 22,4
D. 44,8
Nhận thấy nkết tủa = 0,2 mol < nK[Al(OH)4] =0,3 mol → Xảy ra 2 trường hợp
- TH1: không xảy ra sư hòa tan kết tủa :
KOH+ HCl → KCl + H2O
x----> x
K[Al(OH)4] + HCl → Al(OH)3 + KCl + H2O
0,3---------> 0,2---------> 0,2
Ta có x+ 0,2 = 1 → x= 0,8 mol → m= 44,8 gam
- TH2: xảy ra sự hòa tan kết tủa
KOH+ HCl → KCl + H2O
x----> x
K[Al(OH)4] + HCl → Al(OH)3 + KCl + H2O
0,2---------> 0,2---------> 0,2
K[Al(OH)4] + 4HCl → AlCl3+ KCl + H2O
0,1---------->0,4
Ta có x+ 0,2 + 0,4 = 1 → x= 0,4 → m = 22,4 gam.
Đáp án A
Đúng 0
Bình luận (0)
Dung dịch A chứa m gam KOH và 40,2 gam K[Al(OH)4]. Cho 500 ml dung dịch HCl 2M vào dung dịch A thu được 15,6 gam kết tủa. Giá trị của m là A. 22,4g hoặc 44,8g B. 12,6g C. 8g hoặc 22,4g D. 44,8g
Đọc tiếp
Dung dịch A chứa m gam KOH và 40,2 gam K[Al(OH)4]. Cho 500 ml dung dịch HCl 2M vào dung dịch A thu được 15,6 gam kết tủa. Giá trị của m là
A. 22,4g hoặc 44,8g
B. 12,6g
C. 8g hoặc 22,4g
D. 44,8g
Dung dịch Al 2 (SO 4 ) 3 có lẫn tạp chất là CuSO 4 . Dùng kim loại nào sau đây để làm sạch dung dịch Al 2 (SO 4 ) 3 ?
A.Cu
B.Mg
C.Zn
D.Al
Dung dịch Al 2 (SO 4 ) 3 có lẫn tạp chất là CuSO 4 . Dùng kim loại nào sau đây để làm sạch dung dịch Al 2 (SO 4 ) 3 ?
A.Cu
B.Mg
C.Zn
D.Al
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Đúng 1
Bình luận (0)
Chọn D vì Al đứng trước Cu trong dãy hd hh nên đẩy đc Cu khỏi dd \(CuSO_4\)
\(2Al+3CuSO_4\to Al_2(SO_4)_3+3Cu\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời