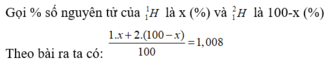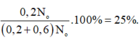Bài 1. Tính thành phần phần % các đồng vị của cacbon. Biết cacbon trong tự nhiên tồn tại hai đồng vị bền là 12C và 13C và có nguyên tử trung bình là 12,011.
Bài 2. Nguyên tử khối trung bình của Ag là 107,87, trong tự nhiên bạc có hai đồng vị là 107Ag và 109Ag. Xác định % số nguyên tử của mỗi đồng vị.
Tính % theo khối lượng của đồng vị 109Ag trong AgNO3 (lấy nguyê tử khối tb N = 14; O = 16)