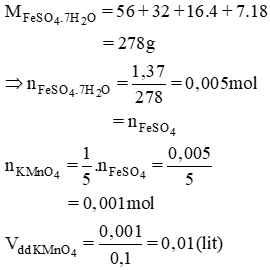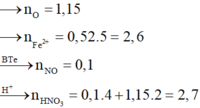Hòa tan 1,39g muối FeSO4.7H2O trong dung dịch H2SO4 loãng. Cho dung dịch này tác dụng với dung dịch KMnO4 0,1M. Tính thể tích dung dịch KMnO4 tham gia phản ứng.

Những câu hỏi liên quan
Hòa tan 1,39g muối FeSO4.7H2O trong dung dịch H2SO4 loãng. Cho dung dịch này tác dụng với dung dịch KMnO4 0,1M. Tính thể tích dung dịch KMnO4 tham gia phản ứng.
10FeSO4 + 2KMnO4 + 8H2SO4 -> 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
\(nFeSO4.7H2O=\dfrac{1.39}{56+32+64+7\times18}=5\times10^{-3}mol\) = nFeSO4
=> \(nKMnO4=5\times10^{-3}\times\dfrac{1}{5}=10^{-3}mol\)
=> VddKMnO4 = \(\dfrac{10^{-3}}{0.1}=0.01l\)
Đúng 2
Bình luận (1)
Hòa tan 1,39g muối FeSO4.7H2O trong dung dịch H2SO4 loãng. Cho dung dịch này tác dụng với dung dịch KMnO4 0,1M. Tính thể tích dung dịch KMnO4 tham gia phản ứng.
( giúp anh mik đang ôn thi )
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
*tk
Đúng 5
Bình luận (3)
Hòa tan hoàn toàn 5,56g FeSO4.7H2O vào nước được dung dịch X, X tác dụng vừa đủ với V (ml) dung dịch KMnO4 0,1M (có H2SO4 loãng dư làm môi trường). Giá trị của V là:
A. 20,0
B. 35,0
C. 40,0
D. 30,0
Đáp án C
nFeSO4 = nFeSO4.7H2O = 5,56: 278 = 0,02 mol
Fe+2 → Fe+3 + 1e
Mn+7 + 5e → Mn+2
=> Bảo toàn electron: nFeSO4 = 5nKMnO4 => nKMnO4 = 0,02: 5 = 0,004 mol
=> Vdd KMnO4 = 0,004: 0,1 = 0,04 lít = 40 ml
Đúng 0
Bình luận (0)
Hòa tan m gam Fe vào dung dịch H2SO4 loãng thu được dung dịch X Dung dịch X phản ứng vừa đủ với 200ml dung dịch KMnO4 0,1M trong môi trường H2SO4 loãng dư.Tính giá trị của m bit NTK của Fe=56
FeSO4 sao tác dụng được với KMnO4 nhỉ?
Đúng 1
Bình luận (0)
Hoà tan 10 gam hỗn hợp bột Fe và
F
e
2
O
3
bằng dung dịch
H
2
S
O
4
loãng dư thu được 0,672 lít khí (đktc) và dung dịch X. Cho dung dịch X tác dụng vài NaOH dư, thu được kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi được 11,2 gam chất rắn. Thể tích dung dịch
K
M
n
O...
Đọc tiếp
Hoà tan 10 gam hỗn hợp bột Fe và F e 2 O 3 bằng dung dịch H 2 S O 4 loãng dư thu được 0,672 lít khí (đktc) và dung dịch X. Cho dung dịch X tác dụng vài NaOH dư, thu được kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi được 11,2 gam chất rắn. Thể tích dung dịch K M n O 4 0,1M cần phản ứng vừa đủ với dung dịch X là
A. 180 ml
B. 60 ml
C. 100 ml
D. 120 ml
Hỗn hợp X gồm FeO, Fe2O3, Fe3O4, CuO. Hoà tan m gam hỗn hợp X trong dung dịch HCl vừa đủ thu được dung dịch Y chứa m + 63,25 gam chất tan. Dung dịch Y tác dụng với tối đa 0,52 mol KMnO4 trong môi trường H2SO4. Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư (sản phẩm khử duy nhất là NO) thì số mol HNO3 tham gia phản ứng là A. 3,0 B. 2,8 C. 2,9 D. 2,7
Đọc tiếp
Hỗn hợp X gồm FeO, Fe2O3, Fe3O4, CuO. Hoà tan m gam hỗn hợp X trong dung dịch HCl vừa đủ thu được dung dịch Y chứa m + 63,25 gam chất tan. Dung dịch Y tác dụng với tối đa 0,52 mol KMnO4 trong môi trường H2SO4. Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư (sản phẩm khử duy nhất là NO) thì số mol HNO3 tham gia phản ứng là
A. 3,0
B. 2,8
C. 2,9
D. 2,7
Hoà tan a gam FeSO4.7H2O vào nước được dung dịch A. Khi chuẩn độ dung dịch A cần dùng 20 ml dung dịch KMnO4 0,1M (có H2SO4 loãng làm môi trường). Giá trị của a là : A. 1,78 gam B. 2,78 gam C. 3,78 gam D. 3,87 gam
Đọc tiếp
Hoà tan a gam FeSO4.7H2O vào nước được dung dịch A. Khi chuẩn độ dung dịch A cần dùng 20 ml dung dịch KMnO4 0,1M (có H2SO4 loãng làm môi trường). Giá trị của a là :
A. 1,78 gam
B. 2,78 gam
C. 3,78 gam
D. 3,87 gam
Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X? A. 0,1l B. 0,12l C. 0,2l D.0,24l
Đọc tiếp
Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X?
A. 0,1l
B. 0,12l
C. 0,2l
D.0,24l
Đáp án C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có:
Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O
0,02 0,02
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 l
Đúng 0
Bình luận (0)
Hòa tan m gam Fe vào dung dịch H2SO4 loãng thu được dung dịch X Dung dịch X phản ứng vừa đủ với 200ml dung dịch KMnO4 0,3M trong môi trường H2SO4 loãng dư.Tính giá trị của m bit NTK của Fe56
Đọc tiếp
Hòa tan m gam Fe vào dung dịch H2SO4 loãng thu được dung dịch X Dung dịch X phản ứng vừa đủ với 200ml dung dịch KMnO4 0,3M trong môi trường H2SO4 loãng dư.Tính giá trị của m bit NTK của Fe=56
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O Fe+2 => Fe+3 + 1e Mn+7 + 5e => Mn+2 BT e : nFeSO4 = 5nKMnO4 = 5 * 0.2 * 0.3 = 0.3 (mol) BT nguyên tố Fe : nFe = nFeSO4 = 0.3 (mol) => mFe = 16.8 g
Đúng 0
Bình luận (1)
Fe + H2SO4 → FeSO4 + H2
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
nFeSO4 = 5nKMnO4 = 0,3. 0,2. 5 = 0,3 mol
=> nFe = 0,3 mol <=> mFe = 0,3 .56= 16,8 gam
Đúng 0
Bình luận (0)