cho 200ml dung dịch HCl 0.1M vào 200ml dung dịch NaOH 0.08M thu được dung dịch A có pH bằng bao nhiêu?
Cho 200ml dung dịch HCl 0,8M vào 200ml dung dịch NaOH 1M thu được dung dịch A có pH bằng bao nhiêu?
2 câu bạn đăng cơ bản là giống nhau, khác mỗi thông số :v
Dạng này thì bạn cứ tìm số mol của H+ và OH- ra rồi xem cái nào dư thì lấy log của dư là được.
\(n_{H^+}=n_{HCl}=0,2.0,8=0,16\left(mol\right)\)
\(n_{OH^-}=1.0,2=0,2\left(mol\right)\)
=> OH dư \(\Rightarrow pOH=1,4\Rightarrow pH=14-1,4=12,6\)
Hòa tan hết m gam hỗn hợp X gồm: Na, Na2O, K, K2O , Ba và BaO, trong đó oxi chiếm 8,75% về khối lượng vào nước thu được 400ml dung dịch Y và 1,568 lít H2( đktc). Trộn 200ml dung dịch Y với 200ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M thu được 400ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
A. 12.
B. 14.
C. 15.
D. 13.
Đáp án D
► Xử lý dữ kiện 200 ml dung dịch Y: nH+ = 0,2 × (0,2 + 0,15 × 2) = 0,1 mol.
pH = 13 ⇒ OH– dư ⇒ [OH–] = 1013 – 14 = 0,1M ⇒ nOH– dư = 0,4 × 0,1 = 0,04 mol.
||⇒ nOH–/Y = 0,04 + 0,1 = 0,14 mol ⇒ 400 ml dung dịch Y chứa 0,28 mol OH–.
► Dễ thấy nOH– = 2nH2 + 2nO/oxit ⇒ nO/oxit = (0,28 – 2 × 0,07) ÷ 2 = 0,07 mol.
||⇒ m = 0,07 × 16 ÷ 0,0875 = 12,8(g)
Cho 100ml dung dịch NaOH 2M vào 300ml dung dịch H2SO4 0,4M thu được dung dịch B
a. Tìm pH của dung dịch B
b. Để trung hòa B cần 200ml dung dịch Ba(OH)2xM. Tìm c
a) ta có : \(\dfrac{NaOH}{\dfrac{0,2}{\dfrac{0,2}{0}}}\dfrac{+}{ }\dfrac{H_2SO_4}{\dfrac{0,12}{\dfrac{0,1}{0,02}}}\dfrac{\rightarrow}{ }\dfrac{Na_2SO_4}{ }\dfrac{+}{ }\dfrac{2H_2O}{ }\)
\(\Rightarrow\dfrac{H_2SO_4}{0,02}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,04}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\) \(\Rightarrow\left[H^+\right]=\dfrac{0,04}{0,4}=0,1\)
ta có : \(pH_B=-\log_{10}0,1=1\)
vậy \(pH\) của dung dịch \(B\) là \(1\)
b) ta có : \(\dfrac{NaOH}{0,2}\dfrac{\rightarrow}{ }\dfrac{Na^+}{ }\dfrac{+}{ }\dfrac{OH^-}{0,2}\)
\(\dfrac{H_2SO_4}{0,12}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,24}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\)
\(\dfrac{Ba\left(OH\right)_2}{0,4}\dfrac{\rightarrow}{ }\dfrac{Ba^+}{ }\dfrac{+}{ }\dfrac{2OH^-}{0,8}\)
\(\Rightarrow\dfrac{H^+}{\dfrac{1}{\dfrac{0,24}{0,76}}}\dfrac{+}{ }\dfrac{OH^-}{\dfrac{0,24}{\dfrac{0,24}{0}}}\dfrac{\rightarrow}{ }\dfrac{H_2O}{ }\)
\(\Rightarrow CM_{OH^-}=\left[OH^-\right]=\dfrac{0,76}{0,6}\simeq1,267\left(M\right)\)
vậy .......................................................................................................
Cần thêm vào bao nhiêu ml dung dịch NaOH 0,25M vào 50 ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH =2 ?
A. 35,5 ml
B. 36,5 ml
C. 37,5 ml
D. 38,5 ml
Cần thêm vào bao nhiêu ml dung dịch NaOH 0,25M vào 50 ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH =2 ?
A. 36,5 ml
B. 73ml
C. 22,4ml
D. 300ml
Đáp án A.
Hướng dẫn :
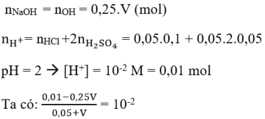
⇒ 0,01 - 0,25.V = 0,01.0,05 + 0,01 V à 0,26.V = 0,01 - 0,01.0,05
⇒ V = 0,0365 l = 36,5 ml
Hòa tan 3,6g một kim loại (chỉ có một hóa trị duy nhất trong hợp chất) vào 200ml dung dịch hỗn hợp HCl 1,25M và H2SO4 1,5M. Dung dịch thu được sau phản ứng làm đỏ quỳ tím và phải trung hòa bằng 100ml dung dịch hỗn hợp NaOH 2,5M và Ba(OH)2 1,5M. Xác định kim loại.
Trộn 200ml dung dịch naoh 1m tác dụng với 100ml dung dịch hcl 1m. Bỏ qua sự thay đổi thể tích khi trộn lẫn.
a. Hỏi dung dịch thu được sau phản ứng có môi trường axit hay bazơ.
b. Tính nồng độ mol của các chất trong dung dịch thu được sau phản ứng
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\cdot1=0,2\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH còn dư
\(\Rightarrow\) Dung dịch sau p/ứ có môi trường bazơ
\(\Rightarrow n_{NaCl}=0,1\left(mol\right)=n_{NaOH\left(dư\right)}\) \(\Rightarrow C_{M_{NaCl}}=\dfrac{0,1}{0,2+0,1}\approx0,33\left(M\right)=C_{M_{NaOH\left(dư\right)}}\)
Trung hòa hoàn toàn 200ml dung dịch KOH 0.5M bằng 200g dung dịch HCL a% . Nồng độ phần trăm của dung dịch (a%) là:
Theo đề ta có PTHH:
KOH + HCl \(\xrightarrow[]{}\) KCl + H2O
Đổi 200ml = 0,2 lít
Theo đề: nKOH= 0,2.0,5= 0,1 (mol)
Theo PTHH:
nHCl= nKOH= 0,1 (mol)
=> mHCl= 0,1. 36,5= 3,65 (g)
=> C% = a%= \(\dfrac{3,65}{200}\times100\%=1,825\%\)
Vậy nồng độ % của dd HCl (a%) là 1,825%
trộn 200ml dung dịch h2so4 0,05M với 300ml dung dịch NaOH 0,06M. Tính nồng độ mol/l cái ion Na+, SO4 2- và pH của dung dịch thu được