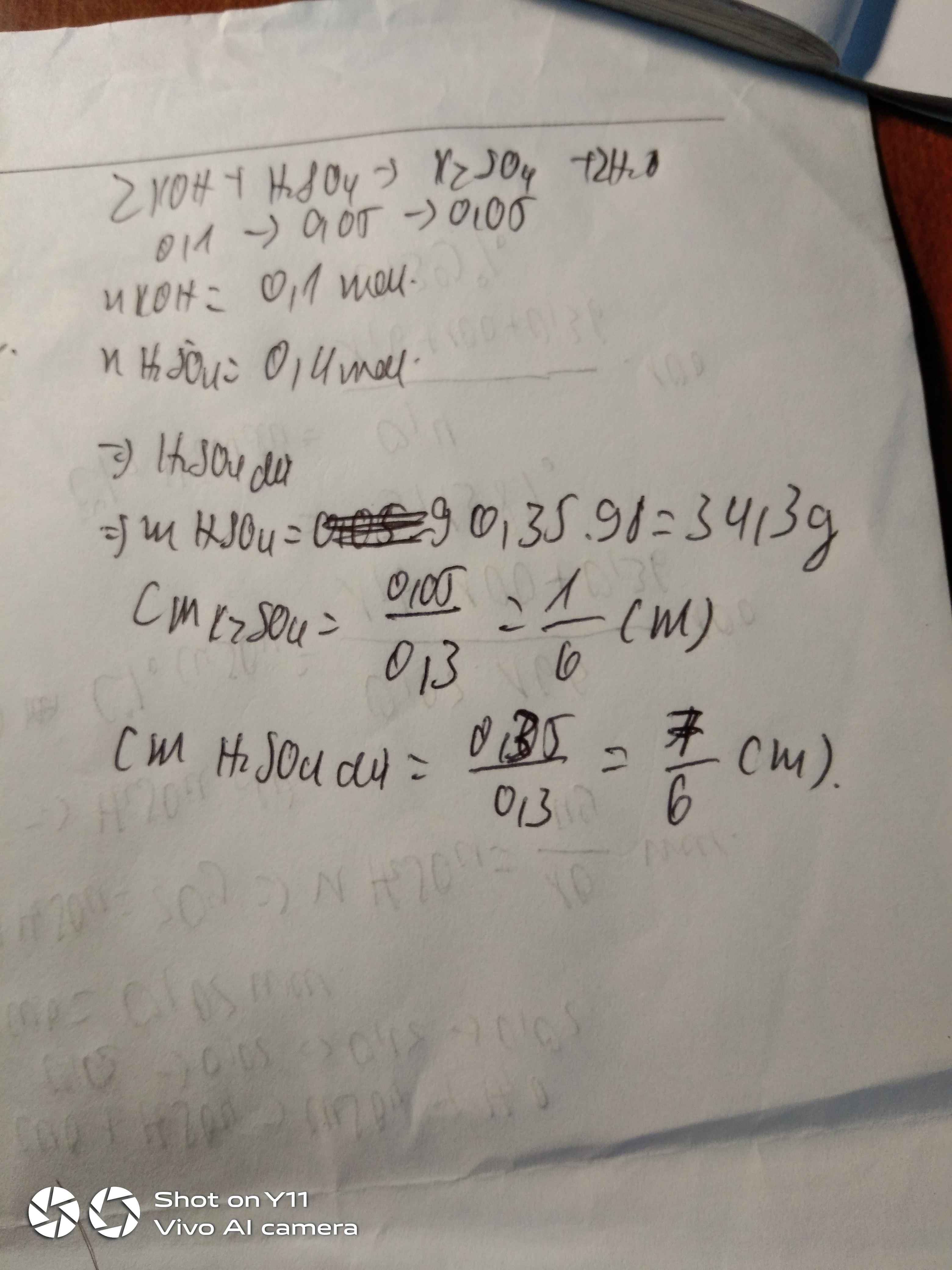Cho 200ml dd NaOH 1M td vớii 200ml dd H2SO4 2M tính nồng độ các ion trong dd sau phản ứng

Những câu hỏi liên quan
Cho 200ml dd NaOH 1M tác dụng với 200 ml dd H2SO4 1M. Tính nồng độ các ion trong dd X
\(n_{NaOH}=0,2\left(mol\right);n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow n_{OH^-}=0,2\left(mol\right);n_{H^+}=0,4\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,4......0,2
Lập tỉ lệ : \(\dfrac{0,4}{1}>\dfrac{0,2}{2}\)
=> H+ dư sau phản ứng
Dung dịch X gồm các ion:
Na+ : 0,2(mol)
SO42- : 0,2 (mol)
H+ dư : 0,2mol
=> \(\left[Na^+\right]=\dfrac{0,2}{0,4}=0,5M\)
\(\left[SO_4^{2-}\right]=\dfrac{0,2}{0,4}=0,5M\)
\(\left[H^+\right]=\dfrac{0,2}{0,4}=0,5M\)
Đúng 2
Bình luận (0)
$n_{NaOH} = 0,2(mol) ; n_{H_2SO_4} = 0,2(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{NaOH} : 2 < n_{H_2SO_4} : 1$ nên $H_2SO_4$ dư
$n_{Na_2SO_4} = n_{H_2SO_4\ pư} = \dfrac{1}{2}n_{NaOH} = 0,1(mol)$
$V_{dd} = 0,2 + 0,2 = 0,4(lít)$
$C_{M_{Na_2SO_4}} = \dfrac{0,1}{0,4} = 0,25M$
$C_{M_{H_2SO_4\ dư}} = \dfrac{0,2-0,1}{0,4} = 0,25M$
Suy ra :
$[Na^+] = 0,25.2 = 0,5M$
$[H^+] = 0,25.2 = 0,5M$
$[SO_4^{2-}] = 0,25 + 0,25 = 0,5M$
Đúng 1
Bình luận (0)
cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng
Cho 200ml dd NaOH 1M tác dụng với 200ml dd H2SO4 2M. Tính nộng độ các ion trong dd sau pứ?
Ta có: \(n_{Na^+}=n_{OH^-}=n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(n_{SO_4^{2-}}=n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
\(n_{H^+}=2n_{H_2SO_4}=0,8\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,2 ← 0,2 _________ (mol)
\(\Rightarrow n_{H^+\left(dư\right)}=0,6\left(mol\right)\)
Dung dịch thu được gồm: Na+, SO42- và H+
\(\Rightarrow\left\{{}\begin{matrix}\left[Na^+\right]=\frac{0,2}{0,4}=0,5M\\\left[SO_4^{2-}\right]=\frac{0,4}{0,4}=1M\\\left[H^+\right]=\frac{0,6}{0,4}=1,5M\end{matrix}\right.\)
Bạn tham khảo nhé!
Tính nồng độ mol/l của các ion trong dd thu được khi: a) Cho 300ml dd AgNO3 1M vào 200ml dd CaCl2 1M b) Cho 4 gam NaOH vào 200ml dd H2SO4 0,01M ( coi thể tích dung dịch ko đổi) c) Cho 50ml dd Na2CO3 0,1M và 50ml ddHCl 0,5M
Trộn 200ml dd NaOH với 300 ml dd H2SO4 2M tính nồng độ MOL sau phản ứng
300ml NaOH 0,1 M
=> n OH- = 0,1 * 0,3 = 0,03 mol
300ml Ba(OH)2 0,025 M
=> n OH- = 2 * 0,025 * 0,3 = 0,015 mol
vậy n OH- = 0,03 + 0,015 = 0,045 mol
200ml dd H2SO4 có nồng độ x M
=> n H+ = 2 * 0,2 * x = 0,4x mol
sau phản ứng thu được 500ml dd có pH=2
pH=2 => [H+] dư = 10^-2 = 0,01 M
=> n H+ dư = 0,01 * 0,5 = 0,005 mol
H+ + OH- ---> H2O
0,045 <---0,045
ta có: 0,4x = 0,045 + 0,005 (số mol đề bài = số mol pu + số mol dư)
=> x = 0,125 M
--------------------------------------...
n SO4 2- = 0,2x = 0,2 * 0,125 = 0,025 mol
n Ba 2+ = 0,025 * 0,3 = 0,0075 mol
Ba 2+ + SO4 2- ---> BaSO4
0,0075 --> 0,0075
m BaSO4 = 0,0075 * 233 = 1,7475 g
Đúng 0
Bình luận (0)
Trộn 300ml dd h2so4 2M với 200ml dd h2so4 1M. Tính nồng độ mol dd h2so4 trog phản ứng trên
áp dụng quy tắc đường chéo
0,3l dd H2SO4 2M-----------------x-1 (M)
------------------------- x(M)
0,2l dd H2SO4 1M------------------2-x (M)
trong đó x là nồng độ mol của dd H2SO4 THU ĐƯỢC
=> \(\dfrac{0,3}{0,2}=\dfrac{3}{2}=\dfrac{x-1}{2-x}\)
giải PT=> x=1,6 (M)
Đúng 0
Bình luận (1)
+) Ta có: \(V_{ddH_2SO_4\left(1\right)}=300\left(ml\right)=0,3\left(l\right)\\ V_{ddH_2SO_4\left(2\right)}=200\left(ml\right)=0,2\left(l\right)\)
=> \(n_{H_2SO_4\left(1\right)}=0,3.2=0,6\left(mol\right)\\ n_{H_2SO_4\left(2\right)}=0,2.1=0,2\left(mol\right)\)
=> Nồng độ mol của dung dịch H2SO4 sau trộn:
\(C_{MddH_2SO_4\left(mới\right)}=\dfrac{0,6+0,2}{0,3+0,2}=1,6\left(M\right)\)
Đúng 0
Bình luận (1)
Trung hòa 20 ml dd NaOH 2M, cần dùng 80 ml dd HSO4 a. Tính nồng độ mol/l của dd H2SO4. b. Tính nồng độ mol/l các ion trong dd sau phản ứng.
\(n_{NaOH}=0,02.2=0,04\left(mol\right)\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ a.n_{H_2SO_4}=n_{Na_2SO_4}=\dfrac{0,04}{2}=0,02\left(mol\right)\\ C_{MddH_2SO_4}=\dfrac{0,02}{0,08}=0,25\left(M\right)\\ b.\left[Na^+\right]=\dfrac{0,02.2}{0,02+0,08}=0,4\left(M\right)\\ \left[SO^{2-}_4\right]=\dfrac{0,02}{0,02+0,08}=0,2\left(M\right)\)
Đúng 2
Bình luận (0)
hấp thụ 2.688 lít khí CO2 (đktc) vào 200ml dd NaOH 1M. Sau phản ứng thu đc dd X. tính nồng độ mol của các chất có trong dd sau phản ứng
giúp e nhe, e cần gấp í
nCO2=0,12(mol)
nNaOH=0,2(mol)
Ta có: 1< nNaOH/nCO2=0,2/0,12=1,667<2
=> Sp thu được hỗn hợp 2 muối Na2CO3 và NaHCO3
Đặt nCO2(1), (2) lần lượt là a, b(mol) (a,b>0)
PTHH: 2 NaOH + CO2 -to-> Na2CO3 + H2O (1)
2a_________a_________a(mol)
NaOH + CO2 -> NaHCO3 (2)
b_____b______b(mol)
Từ (1), (2) ta có hpt:
\(\left\{{}\begin{matrix}2a+b=0,2\\a+b=0,12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,08\\b=0,04\end{matrix}\right.\)
Vddsau=VddNaOH=0,2(l)
=> CMddNaHCO3= 0,04/0,2=0,2(M)
CMddNa2CO3=0,08/0,2=0,4(M)
Đúng 2
Bình luận (0)
\(n_{CO_2}=0,12mol\\ n_{NaOH}=0,2mol\\ T=\frac{n_{NaOH}}{n_{CO_2}}=\frac{0,2}{0,12}=1,66// \to Na2CO_3; NaHCO_3// 2NaOH+CO_2 \to Na_2CO_3\\ NaoH+CO_2 \to NaHCO_3\\ n_{Na_2CO_3}=a(mol)\\ n_{NaHCO_3}=b(mol)\\ n_{NaOH}=2a+b=0,2(1)\\ n_{CO_2}=a+b=0,12(2)\\ (1)(2)\\ a=0,08; b=0,04\\ CM_{Na_2CO_3}=\frac{0,08}{0,2}=0,4(mol)\\ CM_{NaHCO_3}=\frac{0,04}{0,2}=0,2(mol)\\ \)
Đúng 1
Bình luận (3)
Tính nồng độ các ion trong dd thu được khi:
a) Trộn 200ml dd NaCl 2M với 200ml dd CaCl2 0,5M
b) Trộn 200ml dd chứa 12g MgSO4 với 300ml dd chứa 34,2 gam Al2(SO4)3
\(a.n_{NaCl}=0,2.2=0,4\left(mol\right)\\ n_{CaCl_2}=0,5.0,2=0,1\left(mol\right)\\ \left[Na^+\right]=\left[NaCl\right]=\dfrac{0,4.1}{0,2+0,2}=1\left(M\right)\\ \left[Ca^{2+}\right]=\left[CaCl_2\right]=\dfrac{0,1.1}{0,2+0,2}=0,25\left(M\right)\\ \left[Cl^-\right]=1.1+0,25.2=1,5\left(M\right)\)
Đúng 1
Bình luận (0)
\(b.\\ n_{MgSO_4}=\dfrac{12}{120}=0,1\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{34,2}{342}=0,1\left(mol\right)\\ \left[Mg^{2+}\right]=\left[MgSO_4\right]=\dfrac{0,1}{0,2+0,3}=0,2\left(M\right)\\ \left[Al^{3+}\right]=2.\left[Al_2\left(SO_4\right)_3\right]=2.\dfrac{0,1}{0,2+0,3}=0,4\left(M\right)\\ \left[SO^{2-}_4\right]=0,2.1+0,2.3=0,8\left(M\right)\)
Đúng 1
Bình luận (0)