1. Viết phản ứng hóa học xảy ra khi cho Na từ từ đến dư vào dd HCl

Những câu hỏi liên quan
Câu 1: Nêu hiện tượng và viết phương trình hóa học của phản ứng xảy ra khi cho
từ từ đến dư dung dịch NaOH vào dung dịch CuCl2
Xuất hiện kết tủa xanh đậm
$CuCl_2 + 2NaOH \to Cu(OH)_2 + 2NaCl$
Đúng 3
Bình luận (0)
Hiện tượng : Xuất hiện kết tủa màu xanh, không tan trong NaOH
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
Đúng 2
Bình luận (0)
Các phản ứng xảy ra khi thổi từ từ CO2 đến dư vào cốc chứa dung dịch hỗn hợp NaOH, Ca(OH)2.Thứ tự các phản ứng hóa học xảy ra là: A. 2, 1, 3, 4 B. 1, 3, 2, 4 C. 2, 1, 4, 3 D. 1, 2, 3, 4
Đọc tiếp
Các phản ứng xảy ra khi thổi từ từ CO2 đến dư vào cốc chứa dung dịch hỗn hợp NaOH, Ca(OH)2.
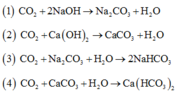
Thứ tự các phản ứng hóa học xảy ra là:
A. 2, 1, 3, 4
B. 1, 3, 2, 4
C. 2, 1, 4, 3
D. 1, 2, 3, 4
Các phản ứng xảy ra khi thổi từ từ
C
O
2
đến dư vào cốc chứa dung dịch hỗn hợp NaOH,
C
a
(
O
H
)
2
. Thứ tự các phản ứng hóa học xảy ra là: A. 2, 1, 3, 4 B. 1, 3, 2, 4 C. 2, 1, 4, 3 D. 1, 2, 3, 4
Đọc tiếp
Các phản ứng xảy ra khi thổi từ từ C O 2 đến dư vào cốc chứa dung dịch hỗn hợp NaOH, C a ( O H ) 2 .
![]()
![]()
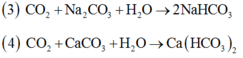
Thứ tự các phản ứng hóa học xảy ra là:
A. 2, 1, 3, 4
B. 1, 3, 2, 4
C. 2, 1, 4, 3
D. 1, 2, 3, 4
Viết phương trình hóa học để giải thích các hiện tượng xảy ra khi. Cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
Cho từ từ đến dư dung dịch HCl vào dd Na[Al(OH)4].
Ban đầu xuất hiện kết tủa trắng keo của Al(OH)3 sau đó khi HCl dư thì kết tủa tan ra
2NaAlO2 + 2HCl + 2H2O → 2NaCl + 2Al(OH)3↓
3HCl + Al(OH)3 → AlCl3 + 3H2O
Đúng 0
Bình luận (0)
Câu 1: (2 điểm)1. Nêu hiện tượng và viết phương trình hoá học xảy ra khi: Cho dây sắt vào dung dịch axit HCl dư, thêm từ từ đến dư dung dịch KOH vào dung dịch sau phản ứng, sau đó để một thời gian ngoài không khí.2. Cho 100 ml dung dịch H2SO4 20% (d 1,14g/ml) vào 400 gam dung dịch BaCl2 5,2%. Khi kết thúc phản ứng thu được kết tủa A và dung dịch B. Tính lượng kết tủa A và nồng độ % các chất trong dung dịch B.
Đọc tiếp
Câu 1: (2 điểm)
1. Nêu hiện tượng và viết phương trình hoá học xảy ra khi: Cho dây sắt vào dung dịch axit HCl dư, thêm từ từ đến dư dung dịch KOH vào dung dịch sau phản ứng, sau đó để một thời gian ngoài không khí.
2. Cho 100 ml dung dịch H2SO4 20% (d = 1,14g/ml) vào 400 gam dung dịch BaCl2 5,2%. Khi kết thúc phản ứng thu được kết tủa A và dung dịch B. Tính lượng kết tủa A và nồng độ % các chất trong dung dịch B.
1) Dây sắt tan dần, xuất hiện khí không màu và kết tủa màu trắng xanh hóa nâu vàng khi để ngoài không khí.
$Fe + 2HCl \to FeCl_2 + H_2$
$FeCl_2 + 2KOH \to Fe(OH)_2 + 2KCl$
$4Fe(OH)_2 + O_2 + 2H_2O \to 4Fe(OH)_3$
Đúng 2
Bình luận (3)
2.nBaCl2= 0,1 (mol)
nH2SO4 = 0,2327 (mol)
BaCl2 + H2SO4 →BaSO4 ↓ + 2HCl
bđ 0,1.....0,2327
pư 0,1 ....0,1...........0,1.............0,2 (mol)
spư 0.......0,1327....0,1..............0,2
mBaSO4 = 0,1 . 233 = 23,3 (g)
mdd(sau pư)= 400 + 1,14 . 100 - 23,3 =490,7 (g)
C%(H2SO4 dư)=\(\dfrac{0,137.98}{490,7}.100\)= 2,65%
C% (HCl) =\(\dfrac{0,2.36,5}{490,7}.100\) = 1,49%
Đúng 2
Bình luận (1)
Nêu hiện tượng quan sát và viết PTHH xảy ra ghi rõ điều kiện phản ứng 1. cho mẫu kẽm vào ống nghiệm chứa đ HCl (dư) 2. cho tư từ dd BACl2 vào ống nghiệm chứ dd H2SO43. cho từ từ dd HCl vào ống nghiệm chứa dd NAOH có để sẵn 1 mẫu giấy quỳ tím 4. cho đinh sắt vào ống nghiệm chứa dd CUSO45. cho NA2CO3 vào dd HCl 6. nung nóng Cu(OH)27. cho dd CUSO4 vào dd NAOH cứu tuii với :((
Đọc tiếp
Nêu hiện tượng quan sát và viết PTHH xảy ra ghi rõ điều kiện phản ứng
1. cho mẫu kẽm vào ống nghiệm chứa đ HCl (dư)
2. cho tư từ dd BACl2 vào ống nghiệm chứ dd H2SO4
3. cho từ từ dd HCl vào ống nghiệm chứa dd NAOH có để sẵn 1 mẫu giấy quỳ tím
4. cho đinh sắt vào ống nghiệm chứa dd CUSO4
5. cho NA2CO3 vào dd HCl
6. nung nóng Cu(OH)2
7. cho dd CUSO4 vào dd NAOH
cứu tuii với :((
1. Mẩu kẽm tan dần, có hiện tượng sủi bọt khí.
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
2. Xuất hiện kết tủa trắng.
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_{4\downarrow}\)
3. Ban đầu quỳ tím hóa xanh, sau khi cho HCl vào, quỳ tím dần trở lại màu tím. Khi HCl dư, quỳ tím hóa đỏ.
PT: \(HCl+NaOH\rightarrow NaCl+H_2O\)
4. Đinh sắt tan dần, có chất rắn màu đỏ đồng bám vào đinh sắt, màu xanh của dd nhạt dần.
PT: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
5. Xuất hiện bọt khí.
PT: \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
6. Chất rắn chuyển từ màu xanh sang đen, có hơi nước thoát ra.
PT: \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
7. Xuất hiện kết tủa xanh.
PT: \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Đúng 1
Bình luận (0)
1) chỉ dùng thêm 1 dd làm thuốc thử, hãy nhận biết: etilen, axetilen và lưu huỳnh đioxit
2) Cho từ từ đến hết 140ml dd NaOH 1M vào cốc đựng sẵn 100ml dd chứa AlCl3 0,3M và HCl 0,4M đến khi phản ứng xảy ra hoàn toàn. Viết pt và tính kl kết tủa
\(n_{NaOH}=0,14\left(mol\right);n_{AlCl_3}=0,03\left(mol\right);n_{HCl}=0,04\left(mol\right)\)
Phản ứng trung hòa của axit và bazo xảy ra đầu tiên
NaOH + HCl -------> NaCl + H2O
0,04<----0,04
=> \(n_{NaOH\left(conlai\right)}=0,14-0,04=0,1\left(mol\right)\)
3NaOH + AlCl3 -------> 3NaCl + Al(OH)3
0,1...........0,03
Lập tỉ lệ : \(\dfrac{0,1}{3}>\dfrac{0,03}{3}\) => Sau phản ứng NaOH dư
=> \(n_{NaOH\left(dư\right)}=0,1-0,03.3=0,01\left(mol\right)\)
Al(OH)3 + NaOH -------> NaAlO2 + 2H2O
0,03..........0,01
Lập tỉ lệ : \(\dfrac{0,03}{1}>\dfrac{0,01}{1}\) =>Sau phản ứng Al(OH)3 dư
\(n_{Al\left(OH\right)_3}=0,03-0,01=0,02\left(mol\right)\)
=> \(m_{Al\left(OH\right)_3}=0,02.78=1,56\left(g\right)\)
Đúng 0
Bình luận (0)
1) Trích mỗi lọ 1 ít làm mẫu thử
Cho các khí qua dung dịch AgNO3/NH3
+ Khí nào xuất hiện kết tủa màu vàng : C2H2
CH≡CH + 2AgNO3 + 2NH3 → Ag–C≡C-Ag↓ + 2NH4NO3
+ 2 khí không có hiện tượng : etilen và lưu huỳnh đioxit
Đốt 2 khí không có hiện tượng trong không khí
+Khí nào cháy được : etilen
C2H4 + 3O2 → 2CO2 + 2H2O
+SO2 không cháy được
Đúng 0
Bình luận (0)
Viết PTHH của phản ứng xảy ra trong mỗi trường hợp sau:
a) Sục khí CO2 từ từ đến dư vào dd Ca(OH)2
b) Nhỏ từ từ dd H3PO4 vào dd NaOH
c) Nhỏ từ từ dd Ca(OH)2 vào dd H3PO4
d) Nhỏ dd NaOH từ từ đén dư vào dd AlCl3
e) Nhỏ dd NaOH từ từ đến dư vào dd ZnSO4
g) Nhỏ dd HCl từ từ đến dư vào dd Na2CO3
a) \(CO2+Ca\left(OH\right)2\rightarrow CaCO3+H2O\)
\(CO2+CaCO3+H2O\rightarrow Ca\left(HCO3\right)2\)
b) \(H3PO4+3NaOH\rightarrow Na3PO4+3H2O\)
\(2Na3PO4+H3PO4\rightarrow3Na2HPO4\)
c)\(Ca\left(OH\right)2+2H3PO4\rightarrow Ca\left(H2PO4\right)2+2H2O\)
\(2Ca\left(OH\right)2+Ca\left(H2PO4\right)2\rightarrow Ca3\left(PO4\right)2+4H2O\)
d)\(3NaOH+AlCl3\rightarrow3NaCl+Al\left(OH\right)3\)
\(2NaOH+2Al\left(OH\right)3\rightarrow2NaAlO2+4H2O\)
e)\(2NaOH+ZnSO4\rightarrow Zn\left(OH\right)2+Na2SO4\)
\(2NaOH+Zn\left(OH\right)2\rightarrow Na2ZnO2+2H2O\)
g) \(HCl+Na2CO3\rightarrow NaCl+NaHCO3\)
\(2HCl+Na2CO3\rightarrow2NaCl+H2O+CO2\)
Chúc bạn học tốt
Đúng 1
Bình luận (2)
Hiện tượng nào xảy ra khi cho từ từ dd HCl đến dư vào dd KAlO2
Xuất hiện kết tủa keo trắng , sau đó kết tủa tan dần.
KAlO2 + HCl + H2O → Al(OH)3↓ + KCl
Al(OH)3 ↓ + 3HCl → AlCl3 + 3H2O
Đúng 2
Bình luận (0)

















