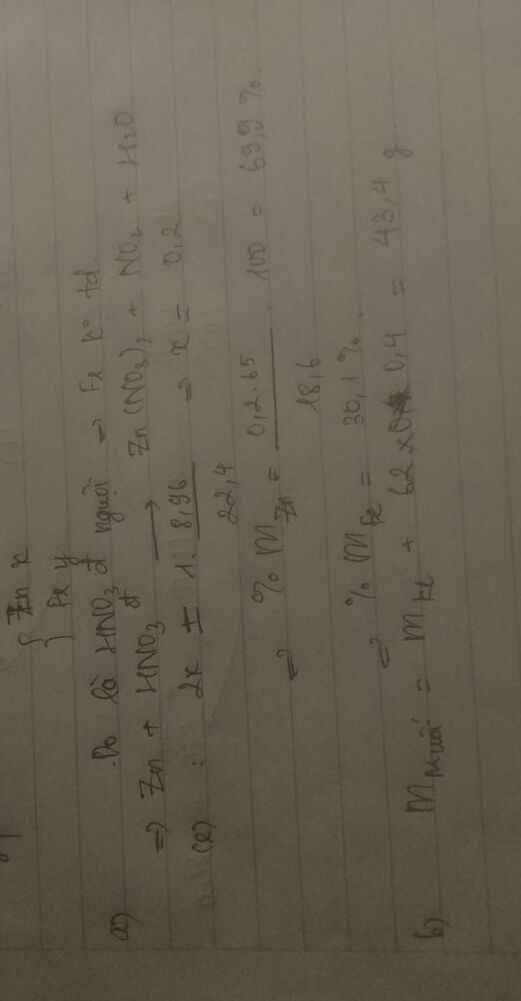cho 12g hỗn hợp fe và ag tá đụng vs hcl, thu đc 3,36l khí h2 ở đktc. tính %khối luộng từng chất

Những câu hỏi liên quan
cho hỗn hợp 12(g) gồm Ag và Fe tác dụng với HCl thu đc 3,36l kí H2 ở đktc. Tính %khối lượng từng chất trong hỗn hợp
Ta có:
\(n_{Fe}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow n_{H2}=n_{Fe}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\frac{8,4}{12}.100\%=70\%\\\%m_{Ag}=100\%-70\%=30\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
hòa tan 12g hỗn hợp gồm Fe và Cu bằng 200ml dd HCl thu đc tối đa 2,24 lít khí Hidro ( đktc) và chất rắn A
a) Tính khối lượng chất rắn A
b) tính nồng độ mol của dd HCl cần dùng
c) Tính phần trăm khối lượng các kim loại trong hỗn hợp ban đầu
giúp mik vs nhé, cảm ơn rất nhiều
Vì Cu không tác dụng với HCl
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,1 0,2 0,1
a) \(n_{Fe}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
\(m_{Cu}=12-5,6=6,4\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
c) 0/0Fe = \(\dfrac{5,6.100}{12}=46,67\)0/0
0/0Cu = \(\dfrac{6,4.100}{12}=53,33\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (2)
cho 21 gam hỗn hợp X(Fe Mg Zn) tác dụng với dd HCl dư thoát ra 8,96dm³ khí (đktc). thêm KOH dư vào dd thu đc rồi lọc tách kết tủa nung đến nóng đến khối lượng không đổi cân đc 12g. at viếy PTPƯ xảy ra. b tính khối lượng từng chất trong hỗn hợp X(tính % các chất trong hh X)
Cho 12g hỗn hợp Fe và Cu tác dụng hết với 200ml dd HCl. Sau phản ứng thu được 2,24 lít khí H2 (ở đktc). Tính khối lượng Cu và nồng độ mol dd HCl đã dùng.
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.1......0.2....................0.1\)
\(m_{Cu}=m_{hh}-m_{Fe}=12-0.1\cdot56=6.4\left(g\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
Đúng 1
Bình luận (0)
hỗn hợp A gồm Fe và Cu có khối lượng là 12g hòa tan A trong HNO3 nóng dư thu được hỗn hợp khí B gồm NO và NO2 tỷ khối của B với H2 là 18 dung dịch sau pư cho tác dụng với NH3 dư lọc kết tủa được duung dịch D nung kết tủa ở không khí đến khối lượng ko đổi thu đc 8g chất rắna) tính %m từng chất trong hỗn hợp ban đầu b) tính thể tích hỗn hợp khí thoát ra ở đktcc) cho 1 chất nguyên chất tác dụng với D thấy khí thoát ra hỏi chất đó là chất gì viết phương trình phản ứng
Đọc tiếp
hỗn hợp A gồm Fe và Cu có khối lượng là 12g hòa tan A trong HNO3 nóng dư thu được hỗn hợp khí B gồm NO và NO2 tỷ khối của B với H2 là 18 dung dịch sau pư cho tác dụng với NH3 dư lọc kết tủa được duung dịch D nung kết tủa ở không khí đến khối lượng ko đổi thu đc 8g chất rắn
a) tính %m từng chất trong hỗn hợp ban đầu
b) tính thể tích hỗn hợp khí thoát ra ở đktc
c) cho 1 chất nguyên chất tác dụng với D thấy khí thoát ra hỏi chất đó là chất gì viết phương trình phản ứng
Do HNO3 nóng dư nên Fe, Cu pứ hết --> Fe3+ & Cu2+
M(B) = 36 --> nNO : nNO2 = 5:3
Khi cho đ sau pứ tác dụng vs NH3 dư thì --> Fe(OH)3 ko tan, Cu(NH3)4(OH)2 tan
--> Chất rắn sau nung: Fe2O3: n = 0,05 --> nFe = 0,1 -->mFe = 5,6, mCu = 6,4g
Từ nFe, nCu, bảo toàn electron --> nNO, nNO2 --> V
c, Dung dịch kiềm> Vì trong dd D có NH4NHO3, nên cho kiềm vào sẽ sinh ra NH3.
Đúng 0
Bình luận (0)
Cho 10g hỗn hợp gồm Fe và Cứ tác dụng với đang dịch HCl 0,5M. Sau phản ứng thu được 3,36l khí (đktc) và chất rắn A không tan a. Tính khối lượng Fe trong hỗn hợp ban đầu b. Tính khối lượng Cứ trong hỗn hợp ban đầu c. Tính thể tích dung dịch HCl đã tham gia phản ứng Giúp em với ạ
Vì Cu không tác dụng với HCl, nên chỉ có phản ứng của Fe.
PTHH: Fe+2HCl\(\rightarrow\)FeCl2+H2
a) nH2=0,15(mol)
Theo pt: nFe=nH2=0,15 (mol)
\(\Rightarrow\)mFe=8,4(g)
b) mCu=10-8,4=1,6(g)
c) Theo pt: nHCl=nH2=0,15(mol)
\(\Rightarrow\)VHCl=0,3(l)
Đúng 1
Bình luận (0)
Cho 12g hỗn hợp X gồm Fe ѵà FeO tác dụng vừa đủ với dung dịch HCl .sau phản ứng thu được 3,36lít khí H2 (đktc) a) viết phương trình hóa học b) tính khối lượng mỗi chất trong hỗn hợp X ѵà thể tích dùng dung dịch HCl 2M đã dùng c) cho lượng hỗn hợp X nói trên ѵào dung dịch CuSO4dư thì sau phản ứng thu được bao nhiêu gam chất rắn
Cho m gam hỗn hợp Al và Fe tác dụng vừa đủ với dd HCl 2M, thu đc dd muối A và 1,456lits H2 ở đktc. Mặt khác cho lượng hỗn hợp trên tác dụng với dd NaOH dư, thu đc 1,12 g chất rắn không tan.
a) tính khối lượng và% khối lượng mỗi chất trong hỗn hợp nói trên
b) tính khối lượng muối thu đc trong ddA
a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ 2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Cho hỗn hợp tác dụng với NaOH, chất rắn không tan là Fe
=> mFe= 1,12 (g) \(\Rightarrow n_{Fe}=0,02\left(mol\right)\)
Ta có: \(n_{H_2\left(2\right)}=n_{Fe}=0,02\left(mol\right)\)
=> \(n_{H_2\left(1\right)}=\Sigma n_{H_2}-n_{H_2\left(2\right)}=0,065-0,02=0,045\left(mol\right)\)
\(\Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2\left(1\right)}=0,03\left(mol\right)\)
\(\Rightarrow m_{Al}=0,03.27=0,81\left(g\right)\)
\(\Rightarrow\%m_{Al}=41,97\%,\%m_{Fe}=58,03\%\)
b) \(m_{FeCl_2}=0,02.127=2,54\left(g\right)\\ m_{AlCl_3}=0,03.133,5=4,005\left(g\right)\)
Đúng 0
Bình luận (0)
Hòa tan M gam hỗn hợp Zn và Fe trong dd HCl dư thu đc 39g muối và 6,72 lít khí (đktc).
a. Tính % khối lượng từng chất trong hỗn hợp ban đầu.
b. Tính nồng độ phần trăm của 200g dd HCl.