Dẫn từ từ 17,92 lít hh khí etan và propilen(đktc) vào dd brom dư có 48 gam brom phản ứng
A. Viết PTHH và giải thích hiện tượng
B. Tính thể tích của mỗi khí trong hỗn hợp ban đầu
Dẫn từ từ 4,48 lít hỗn hợp khí etilen và propilen (đktc) vào dung dịch brom dư thấy khối lượng bình brom tăng 7,7 gam. Tính % thể tích của mỗi khí trong hỗn hợp ban đầu.
\(Đặt:n_{C_2H_4}=a\left(mol\right);n_{C_3H_6}=b\left(mol\right)\left(a,b>0\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ C_3H_6+Br_2\rightarrow C_3H_6Br_2\\ m_{tăng}=m_{hh.ban.đầu}=7,7\left(g\right)\\ \Rightarrow Hpt:\left\{{}\begin{matrix}28a+42b=7,7\\a+b=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
Vì thể tích tỉ lệ thuận với số mol nên ta có:
\(\%V_{C_2H_4\left(đktc\right)}=\%n_{C_2H_4}=\dfrac{a}{a+b}.100\%=\dfrac{0,05}{0,2}.100=25\%\\ \Rightarrow\%V_{C_3H_6}=100\%-25\%=75\%\)
Dẫn từ từ 3,36 lít hỗn hợp khí etilen và propilen(đktc) vào dung dich brom thấy dung dich bị nhạt màu và không có khí thoát ra .Khối lượng dung dịch sau phản ứng tăng 4,9 gam. Tính % theo thể tích của mỗi khí trong hỗn hợp ban đầu.?
\(n_{C_2H_4} = a\ mol;n_{C_3H_6} = b\ mol\\ \Rightarrow a + b = \dfrac{3,36}{22,4} = 0,15(1)\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ C_3H_6 + Br_2 \to C_3H_6Br_2\\ m_{tăng} = 28a + 42b = 4,9(2)\\ (1)(2)\Rightarrow a = 0,1; b = 0,05\\ \%V_{C_2H_4} = \dfrac{0,1}{0,15}.100\% = 66,67\%\\ \%V_{C_3H_6} = 100\% -66,67\% = 33,33\%\)
Dẫn từ từ 3,36 lít hỗn hợp gồm etilen và propilen (đktc) vào dung dịch brom thấy dung dịch bị nhạt màu và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 4,90gam.
a) Viết các phương trình hóa học và giải thích các hiện tượng ở thí nghiệm trên.
b) Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ban đầu.
a) Các phương trình hóa học của phản ứng:
CH2 = CH2 + Br2 à CH2Br – CH2Br
CH2 = CH – CH3 + Br2 à CH2Br – CHBr – CH3
Giải thích: Dung dịch brom bị nhạt màu do brom phản ứng với hỗn hợp tạo thành các hợp chất không màu. Khối lượngbinhf tăng do các sản phẩm tạo thành là những chất lỏng
b) Gọi x,y lần lượt là số mol của C2H4 và C3H6 :
=>
=> %V C2H4 = 66,7%
%V C3H6 = 33,3%
a) Các phương trình hóa học của phản ứng:
CH2 = CH2 + Br2 à CH2Br – CH2Br
CH2 = CH – CH3 + Br2 à CH2Br – CHBr – CH3
b) Gọi x,y lần lượt là số mol của C2H4 và C3H6 :
=>
=> %V C2H4 = 66,7%
%V C3H6 = 33,3%
Dẫn 2,8 lít hỗn hợp Metan (CH4), Etilen (C2H4) đi qua bình đựng dd Brom dư, thấy có 4 gam Brom phản ứng. Viết PTHH và tính phần trăm thể tích mỗi khí trong hỗn hợp ban đầu?
\(n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right);n_{hh}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,025<-0,125
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,025}{0,125}.100\%=20\%\\\%V_{CH_4}=100\%-20\%=80\%\end{matrix}\right.\)
Đốt 4,48 lít hỗn hợp khí X gồm 1 anken và metan (đktc) vào dd brom dư thấy có 80 gam brom phản ứng. Tính thể tích của mỗi khí trong hỗn hợp ban đầu.?
\(n_{anken} = n_{Br_2} =\dfrac{80}{160} = 0,5(mol)\\ \Rightarrow V_{anken} = 0,5.22,4 = 11,2(lít)\\ \Rightarrow V_{metan} = 4,48 - 11,2 =-6,72 <0\)
(Sai đề)
Câu 1: Dẫn từ từ 4,48 lít hỗn hợp khí etilen và metan (đktc) vào dung dịch brom dư thấy có 24 gam brom phản ứng.
a. Viết PTPU.
b. Tính thể tích của mỗi khí trong hỗn hợp ban đầu lần lượt là (C=12, H=1, Br=80)
C2H4+Br2->C2H4Br2
0,15--0,15 mol
n Br2=\(\dfrac{24}{160}\)=0,15 mol
=>VC2H4=0,15.22,4=3,36l
=>VCH4=4,48-3,36=1,12l
Dẫn 7,84 lít hỗn hợp khí etilen và axetileen lội từ từ qua dd Brom dư thấy có 72 gam brom tham gia phản ứng. Tính thành phần % thể tích mỗi khí trong hỗn hợp đầu.
C2H4 + Br2 -> C2H4Br2
a a a
C2H2 + 2Br2 -> C2H2Br4
b 2b b
n hỗn hợp khí = \(\dfrac{7.84}{22.4}=0.35mol\)
Ta có: \(\left\{{}\begin{matrix}a+b=0.35\\160a+320b=72\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0.25mol\\b=0.1mol\end{matrix}\right.\)
\(\%VC2H4=\dfrac{0.25\times22.4\times100}{7.84}=71.43\%\)
%VC2H2 = 100 - 71.43 = 28.57%
C2H4 + Br2 -> C2H4Br2
a a a
C2H2 + 2Br2 -> C2H2Br4
b 2b b
n hỗn hợp khí = %VC2H4=0.25×22.4×1007.84=71.43%%VC2H4=0.25×22.4×1007.84=71.43%
%VC2H2 = 100 - 71.43 = 28.57%
Dẫn từ từ 3,36 lít hỗn hợp gồm etilen và propilen (đktc) vào dung dịch brom thấy dung dịch bị nhạt màu và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 4,90gam.
Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ban đầu.
Gọi số mol của etilen và propilen lần lượt là x và y mol.
Khối lượng dung dịch sau phản ứng tăng lên chính là khối lượng của hỗn hợp etilen và propilen.
Ta có hệ phương trình:
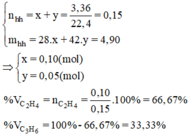
Dẫn 5,6 lít hỗn hợp khí CH4 và C2H2 (ở đktc) vào bình đựng dd brom dư. Sau phản ứng thấy có 48g Br2 đã tham gia phản ứng. Tính thể tích mỗi khí trong hỗn hợp khí ban đầu?
Ta có: \(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
____0,15___0,3 (mol)
\(\Rightarrow\left\{{}\begin{matrix}V_{C_2H_2}=0,15.22,4=3,36\left(l\right)\\V_{CH_4}=2,24\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
$C_2H_2+2Br_2\to Br_2CH-CHBr_2$
$n_{Br_2}=\dfrac{48}{160}=0,3(mol)$
$\Rightarrow n_{C_2H_2}=\dfrac{n_{Br_2}}{2}=0,15(mol)$
$\Rightarrow V_{C_2H_2}=0,15.22,4=3,36(l)$
$\Rightarrow V_{CH_4}=5,6-3,36=2,24(l)$