Đốt cháy hết 1,6 gam CH4 trong oxi thu được khí CO2 và hơi H2O. Khối lượng khí oxi cần để đốt là

Những câu hỏi liên quan
để đốt cháy hết 1,6 gam hợp chât Y cần dùng 1,2.10^23 phân tử oxi , thu được khí co2 và hơi nước theo tỉ lệ số mol là 1:2 . a.tính khối lượng khí co2 và hơi nước tạo thành
b. tính cthh của Y, biết tỉ khối của Y đối vs Hidro là 8
Đốt cháy hoàn toàn 1,6 gam CH4 trong khí oxi dư, sau phản ứng thu được V lít khí CO2 và m gam H2O. Giá trị của V và m lần lượt là
\(n_{CH_4}=\dfrac{1,6}{16}=0,1\left(mol\right)\)
PTHH: \(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
0,1--->0,2----->0,1---->0,2
\(\Rightarrow\left\{{}\begin{matrix}V=V_{CO_2}=0,1.22,4=2,24\left(l\right)\\m=m_{H_2O}=0,2.18=3,6\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Để đốt cháy 16g một chất X cần dùng 44,8 lít khí Oxi(đktc ) thu được khí CO2 và hơi nước theo tỷ lệ mol là 2 : 1 .Tính khối lượng khí CO2 và khối lượng H2O tạo thành.
nO2 = 44,8 : 22,4 = 2 (l)
pthh X + O2 -->2 CO2 +H2O
2---> 4-------> 2 (mol)
=> mCO2 = 4 . 44 = 176(g)
=> mH2O = 2.18 = 36 (g)
Đúng 1
Bình luận (0)
Gọi nH2O = a (mol)
=> nCO2 = 2a (mol)
mH2O = 18a (g)
mCO2 = 2a . 44 = 88a (g)
nO2 = 44,8/22,4 = 2 (mol)
mO2 = 2 . 32 = 64 (g)
Áp dụng ĐLBTKL, ta có:
mX + mO2 = mH2O + mCO2
=> 16 + 64 = 18a + 88a
=> a = 40/53 (mol)
mCO2 = 88 . 40/53 = 3520/53 (g)
mH2O = 18 . 40/53 = 720/53 (g)
Đúng 0
Bình luận (0)
Câu 7. Đốt cháy 1,6 gam chất M cần 6,4 gam khí oxi (O2) thu được khí cacbonic (CO2) và nước (H2O) theo tỷ lệ khối lượng CO2 : khối lượng H2O bằng 11: 9. Tính khối lượng CO2 và H2O sinh ra. Áp dụng ĐLBTKL
Câu 9. Khi nung 300 kg đá vôi có thành phần chính là canxi cacbonat(CaCO3) thu được 140 kg vôi sống (CaO)và 110 kg khí cacbonic(CO2). Tính thành phần % về khối lượng của canxi cacbonat có trong đá vôi.Lập PTHH và áp dụng ĐLBTKL
Đọc tiếp
Câu 7. Đốt cháy 1,6 gam chất M cần 6,4 gam khí oxi (O2) thu được khí cacbonic (CO2) và nước (H2O) theo tỷ lệ khối lượng CO2 : khối lượng H2O bằng 11: 9. Tính khối lượng CO2 và H2O sinh ra. Áp dụng ĐLBTKL Câu 9. Khi nung 300 kg đá vôi có thành phần chính là canxi cacbonat(CaCO3) thu được 140 kg vôi sống (CaO)và 110 kg khí cacbonic(CO2). Tính thành phần % về khối lượng của canxi cacbonat có trong đá vôi.Lập PTHH và áp dụng ĐLBTKL
Đốt cháy hoàn toàn11,2 lít khí metan (CH4 ):
a) Tính thể tích khí oxi cần dùng để đốt cháy hết lượng metan ở trên?
b) Tính khối lượng CO2 và H2O sinh ra sau phản ứng?
c) Dẫn toàn bộ sản phẩm sinh ra ở trên vào dung dịch nước vôi trong lấy dư thu được m(g) kết tủa. Tính m?
Thể tích các khí đo ở đktc
Đáp án:
VO2=22,4 (l); VCO2=11,2 (l)��2=22,4 (�); ���2=11,2 (�)
Giải thích các bước giải:
Ta có:
Đúng 0
Bình luận (0)
câu 1: Đốt cháy hoàn toàn 1,6 gam khí metan (CH4) tạo ra khí cacbonic (CO2) và hơi nước với khối lượng lần lượt là: 4,4 và 1,8 gam.a) Lập PHHH của phản ứngb) Cho biết tỷ lệ số phân tử metan và số phân tử oxi trong phản ứngc) Tính số gam khí oxi đã phản ứng.Câu 2:Đốt cháy hoàn toàn m gam chất X dung 4,48 lít O2 (đktc) thu được 2,24 lít CO2 (đktc) và 3,6 gam H2O. Xác định khối lượng chất X đem dùngcâu 3:Cho 20 gam sắt III sunfat Fe2(SO4)3 tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III...
Đọc tiếp
câu 1: Đốt cháy hoàn toàn 1,6 gam khí metan (CH4) tạo ra khí cacbonic (CO2) và hơi nước với khối lượng lần lượt là: 4,4 và 1,8 gam.
a) Lập PHHH của phản ứng
b) Cho biết tỷ lệ số phân tử metan và số phân tử oxi trong phản ứng
c) Tính số gam khí oxi đã phản ứng.
Câu 2:Đốt cháy hoàn toàn m gam chất X dung 4,48 lít O2 (đktc) thu được 2,24 lít CO2 (đktc) và 3,6 gam H2O. Xác định khối lượng chất X đem dùng
câu 3:Cho 20 gam sắt III sunfat Fe2(SO4)3 tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III hidroxit Fe(OH)3 và 21,3 gam natri sunfat Na2SO4. Xác định khối lượng natri hidroxit tham gia vào phản ứng.
Câu 2 :
Bảo toàn khối lượng :
\(m_X=\dfrac{2.24}{22.4}\cdot44+3.6-\dfrac{4.48}{22.4}\cdot32=1.6\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 1 :
\(CH_4+2O_2\underrightarrow{^{^{t^0}}}CO_2+2H_2O\)
Tỉ lệ số phân tử metan và oxi đã phản ứng = 1 : 2
Bảo toàn khối lượng :
\(m_{O_2}=4.4+1.8-1.6=4.6\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 3 :
Bảo toàn khối lượng
\(m_{NaOH}=10.7+21.3-20=12\left(g\right)\)
Đúng 1
Bình luận (0)
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 1,52 gam chất X cần 0,56 lít oxi (đktc), thu được hỗn hợp khí gồm CO2, N2 và hơi nước. Sau khi ngưng tụ hơi nước hỗn hợp khí còn lại có khối lượng là 1,6 gam và có tỷ khối hơi đối với hidro là 20. Công thức đơn giản nhất của X là A. C3H8O5N2 B. C4H10O5N2 C. C2H6O5N2 D. C3H10O3N2
Đọc tiếp
Đốt cháy hoàn toàn 1,52 gam chất X cần 0,56 lít oxi (đktc), thu được hỗn hợp khí gồm CO2, N2 và hơi nước. Sau khi ngưng tụ hơi nước hỗn hợp khí còn lại có khối lượng là 1,6 gam và có tỷ khối hơi đối với hidro là 20. Công thức đơn giản nhất của X là
A. C3H8O5N2
B. C4H10O5N2
C. C2H6O5N2
D. C3H10O3N2
Đốt cháy hoàn toàn 1,52 gam chất X cần 0,56 lít oxi (đktc), thu được hỗn hợp khí gồm CO2, N2 và hơi nước. Sau khi ngưng tụ hơi nước hỗn hợp khí còn lại có khối lượng là 1,6 gam và có tỷ khối hơi đối với hidro là 20. Công thức đơn giản nhất của X là A. C3H8O5N2 B. C4H10O5N2 C. C2H6O5N2 D. C3H10O3N2
Đọc tiếp
Đốt cháy hoàn toàn 1,52 gam chất X cần 0,56 lít oxi (đktc), thu được hỗn hợp khí gồm CO2, N2 và hơi nước. Sau khi ngưng tụ hơi nước hỗn hợp khí còn lại có khối lượng là 1,6 gam và có tỷ khối hơi đối với hidro là 20. Công thức đơn giản nhất của X là
A. C3H8O5N2
B. C4H10O5N2
C. C2H6O5N2
D. C3H10O3N2
Đáp án A
Định hướng tư duy giải
Ta có:
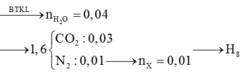
Đúng 0
Bình luận (0)
a) cho 6,72 lít khí CH4 (đktc) phản ứng hết với khí oxi thu được khí cacbon đioxit và hơi nước. Tính thể tích khí oxi cần dùng(đktc) ?
b) đốt cháy 3,1 g photpho trong bình chứa oxi, tạo ra điphotpho pentaoxit. Tính khối lượng oxit thu được?
a.\(n_{CH_4}=\dfrac{V_{CH_4}}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,3 0,6 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,6.22,4=13,44l\)
b.
\(n_P=\dfrac{m_P}{M_P}=\dfrac{3,1}{31}=0,1mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,1 0,05 ( mol )
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,05.142=7,1g\)
Đúng 3
Bình luận (2)























