Giúp e vs e cần rất gấp :((
Nguyên tử R có tổng số hạt là 93 , trong đó số hạt Ko mang điện tích bằng 60,3448% số hạt mang điện
a) Xác định vị trí của R trong BTH các nguyên tố hoá học
b) Xác định nguyên tố R
1:Tổng số hạt cơ bản của nguyên tử nguyên tố X là 36.Trong đó số hạt mang điện gấp đôi số hạt không mang điện.Xác định số hiệu nguyên tử và số khối của nguyên tử X?
2:Tổng số hạt trong nguyên tử là Y là 54 hạt,trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14.
a)Xác định các loại hạt trong Y b)Xác định đơn vị điện tích hạt nhân của Y c)Viết kí hiệu nguyên tử Y
3:Nguyên tử R có tổng số hạt là 115.Số hạt mang điện nhiều hơn số hạt không mang điện là 25.Xác định nguyên tử R từ đó suy ra STT của R?
-Mình cần rất gấp,các bạn giúp mình với!-
1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl
3.
Ntử R có tổng số hạt cơ bản là 115
=> p+e+n=115
=>2p+n=115(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 25
=> 2p-n=25(2)
Từ (1)&(2) => ta có hệ phương trình
=>2p+n=115
2p-n=25
<=>p=35
n=45
=> e=35, p=35, n=45
=> R là Br
STT của Br là 35
Câu 1 : Nguyên tử của nguyên tố X có tổng số hạt là 76 , trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. Xác định kí hiệu và vị trí của X trong BTH . Xác định cấu hình X2 + ; X3 + Xác định 4 số lượng e cuối cùng ; e ngoài cùng Biết Fe ( 56 ) ; Cr ( 52 ) ; Cu ( 64 )
a) Trong ion X3- có tổng số các hạt (p,e,n) là 49, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 17. Xác định số khối, viết cấu hình electron của nguyên tử X và cho biết vị trí của X trong bảng tuần hoàn các nguyên tố hoá học. b) Trong tự nhiên Flo có 2 dồng vị: 18F chiếm 0,2%, xác định số khối của đồng vị thứ 2, biết rằng Flo có nguyên tử khối trung bình là 18,998u
Nguyên tử nguyên tố R có tổng số hạt các loại là 60 hạt. Trong hạt nhân của nguyên tử đó, số hạt mang điện dương bằng số hạt không mang điện.
a.Tính số hạt mỗi loại và viết kí hiệu nguyên tử R?
b. Viết cấu hình electron nguyên tử và xác định vị trí của R trong bảng tuần hoàn, giải thích?
c. Viết cấu hình e của ion tạo bởi R, giải thích?
d.Đốt cháy hết m(g) R trong 4,48 lít khí oxi (đktc). Tính m?
a) Có \(\left\{{}\begin{matrix}p+n+e=2p+n=60\\p=n\end{matrix}\right.=>\left\{{}\begin{matrix}p=e=20\\n=20\end{matrix}\right.\)
=> R là Ca
b)
Cấu hình của Ca: 1s22s22p63s23p64s2
Có 20e => Ca nằm ở ô thứ 20
Có 4 lớp e => Ca thuộc chu kì 4
Có 2e lớp ngoài cùng => Ca thuộc nhóm IIA
c)
Nguyên tử Ca nhường 2e để đạt đến cấu hình bền của khí hiếm, tạo ra ion Ca2+
Cấu hình ion Ca2+ : 1s22s22p63s23p6
d) \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2Ca + O2 --to--> 2CaO
_____0,4<--0,2
=> mCaO = 0,4.40 = 16 (g)
nguyên tử ng tố x có tổng số hạt là 93 trong đó số hạt mang điện gấp 1,657 lần số hạt ko mang điện . tìm số p,e,số khối. xác định tên ng tố đó
Ta có: p + e + n = 93
Mà p = e, nên: 2p + n = 93 (1)
Theo đề, ta có: 2p = 1,657n (2)
Từ (1) và (2), ta có HPT:
\(\left\{{}\begin{matrix}2p+n=93\\2p=1,657n\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=93\\2p-1,657n=0\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2,657n=93\\2p+n=93\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}n\approx35\\p\approx29\end{matrix}\right.\)
Vậy p = e = 29 hạt, n = 35 hạt.
Dựa vào bảng hóa trị, suy ra:
x là đồng (Cu)
Em ví a = b, thì a - b = 0 phải không.
Em đặt 2p là a, 1,657n là b.
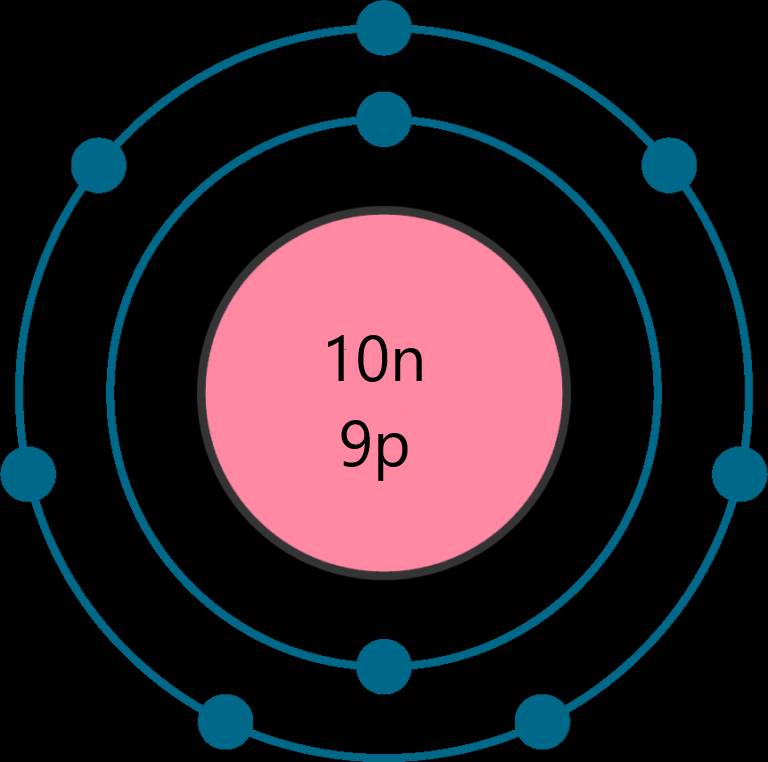
nguyên tử của một nguyên tố có tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8. Xác định số p, số n, số e của nguyên tử nguyên tố đó. Vẽ mô hình nguyên tử. Xác định vị trí của nguyên tố đó trong bảng tuần hoàn.
Tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8
⇒ Số neutron là 10 hạt
Số proton là 9 hạt
Số electron là 9 hạt
⇒ Nguyên tố Fluorine - ô số 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn
câu 1 :nguyên tử r có tổng số hạt bằng 58 trong hạt nhân số hạt ko mang điện ít hơn số hạng mang điện là một hạt
a/viết cấu hình nguyên tử . xác định nguyên tố kim loại , phi kim hay khí hiếm?vì sao
b/viết kí hiệu nguyên tử
c/xác định vị trí x trong bảng tuần hoàn,giải thích
câu 2:một nguyên tử x có tổng số e ở các phân lớp s là 6 và tổng số e lớp ngoài cùng là 5 .viết cấu hình e và gọi tên của x
a) Cho nguyên tử nguyên tố X có tổng số hạt p,n,e là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Bằng kiến thức đã học em hãy - Xác định số Z, N và số khối A của X. - Cho biết tên gọi, kí hiệu hóa học của X. - Xác định vị trí (ô, nhóm, chu kì) của X trong bảng tuần hoàn. b) Nêu tính chất hóa học cơ bản của X và giải thích tại sao?
Có p+n+e = 2p + n = 34
Và 2p - n = 10
=> p = e = 11; n = 12
Z = 11
N = 12
A = 11 + 12 = 23
- Tên gọi: Natri; KHHH: Na
- Cấu hình: 1s22s22p63s1
=> X nằm ở ô thứ 11, nhóm IA, chu kì 3
Do X có 1 e lớp ngoài cùng => X có tính chất của kim loại
ion x- có tổng số hạt là 29 .Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 9
a)Xác định số hạt e,nowtron va số khối của X
b)Viết cấu hình e của X và ion X-
c)Nguyên tử nguyên tố R có cấu hình e lớp vỏ ngoài cùng 3s2
-Cho biết vị trí(chu kì,nhóm) và tên nguyên tố R
-Cho biết công thức hợp chất T tạo từ R và X