trong 8 gam MgO có bao nhhieeu gam nguyên tố Mg

Những câu hỏi liên quan
Khi cho 12 gam MG tác dụng vừa đủ với 8 gam O2 thu được 60 gam MgO. Để thu được 60 gam MgO thì cần bao nhiêu gam Mg?
Hỗn hợp gồm MgSO4 và Fe2(SO4)3, trong đó % khối lượng nguyên tố oxi là 25%.
a/ Tính % khối lượng nguyên tố lưu huỳnh trong hỗn hợp.
b/ Tính % khối lượng nguyên tố oxi trong hỗn hợp.
c/ Từ 64 gam hỗn hợp, có thể điều chế được bao nhiêu gam hỗn hợp Mg và Fe? (2 cách).
a)
Giả sử có 100 gam hỗn hợp
\(m_O=\dfrac{25.100}{100}=25\left(g\right)\)
=> \(n_O=\dfrac{25}{16}=1,5625\left(mol\right)\)
Mà nO = 4.nS
=> \(n_S=\dfrac{1,5625}{4}=\dfrac{25}{64}\left(mol\right)\)
\(\%m_S=\dfrac{\dfrac{25}{64}.32}{100}.100\%=12,5\%\)
b) Đề bài cho rồi mà bn :)
c)
C1: %mkim loại = \(100\%-12,5\%-25\%=62,5\%\)
=> mkim loại = \(\dfrac{64.62,5}{100}=40\left(g\right)\)
C2:
\(m_S=\dfrac{64.12,5}{100}=8\left(g\right)\)
\(m_O=\dfrac{64.25}{100}=16\left(g\right)\)
=> mkim loại = 64 - 8 - 16 = 40 (g)
Đúng 1
Bình luận (0)
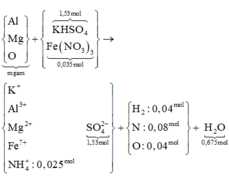
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước đươc dung dich X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó
m
O
64
205
m
Y
) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (ở đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể tích và nguyên tố oxi chiếm 8/23 khối lượn...
Đọc tiếp
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước đươc dung dich X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó m O = 64 205 m Y ) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (ở đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể tích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là
A. 20,0
B. 22,0
C. 22,5
D. 20,5.
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó
m
0
64
205
m
y
) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (tro...
Đọc tiếp
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó m 0 = 64 205 m y ) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể tích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là
A. 22,0.
B. 20,5.
C. 22,5.
D. 20,0.
Đáp án B
nT = 0,09 mol => nH2 = 0,04 mol
mO = 1,84.8/23 = 0,64 (g) => nO = 0,04 mol
mN = 1,84 – mH – mO = 1,84 – 0,04.2 – 0,64 = 1,12 (g) => nN = 0,08 mol
nN :nO = 0,08 :0,04 = 2 :1 => Coi như khí còn lại là N2O

Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó
m
O
64
205
m
Y
) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể thích và nguyên tố oxi c...
Đọc tiếp
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó m O = 64 205 m Y ) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể thích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là
A. 20,0.
B. 22,0.
C. 22,5.
D. 20,5.
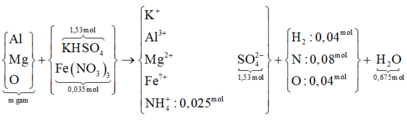
Hỗn hợp khí D gồm 0,04 mol H2
mO/D = 0,64 gam Û nO/D = 0,04 mol
⇒ nN/D = 1 , 84 - 0 , 04 . 2 - 0 , 64 14 = 0,08 mol
Kết tủa là BaSO4 với 1,53 mol → ban đầu có 1,53 mol KHSO4 → Fe(NO3)3 là 0,035 mol.
Bảo toàn N → trong Z có 0,025 mol NH4+; bảo toàn H → nH2O = 0,675 mol.
Bảo toàn O → ∑nO trong Y = 0,4 mol → m = 0,4 × 16 × 205 ÷ 64 = 20,5 gam.
Đáp án D
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó
m
64
205
m
Y
) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể thích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaC...
Đọc tiếp
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó m = 64 205 m Y ) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể thích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là
A. 20,0.
B. 22,0
C. 22,5.
D. 20,5
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 ( trong đó mO mY) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít ( ở đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam ( trong đó H2 chiếm 4/9 về thể tích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là A. 20,0. B. 22,0. C. 22,5. D. 20,5.
Đọc tiếp
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 ( trong đó mO = mY) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít ( ở đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam ( trong đó H2 chiếm 4/9 về thể tích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là
A. 20,0.
B. 22,0.
C. 22,5.
D. 20,5.
Đáp án D
nKHSO4 = nBaSO4 = 1,53 mol => nFe(NO3)3 = ( 216,55 – 1,53.136) : 242 = 0,035 mol
nT = 0,09 mol
nH2 = 4/9. 0,09 = 0,04 mol ; nO = 8/23. 1,84 : 16 = 0,04 mol => nN = ( 1,84 – 0,04.2 – 0,04.16) = 0,08 mol
Do có H2 thoát ra nên NO3- phản ứng hết.
Bảo toàn nguyên tố N: nNH4+ = 3nFe(NO3)3 - nN(T) = 3.0,035 – 0,08 = 0,025 (mol)
Bảo toàn H: nH2O = (nKHSO4 - 4nNH4+ - 2nH2 )/2 = (1,53 - 2.0,025 - 0,04 )/2 = 0,675 mol
Bảo toàn O: 4nKHSO4 + 9nFe(NO3)3 + nO (Y) = nH2O + nO(T) + 4nSO4 2-
=> nO(Y) = ( 0,675 + 0,04 + 4.1,53) – ( 4.1,53 – 9. 0,035) = 0,4
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Mg(NO3)2, Mg(OH)2, MgCO3 có tỉ lệ mol =1:2:3. Nhiệt phân hoàn toàn m gam X thu được m-22,08 gam MgO. Hòa tan toàn bộ lượng MgO sinh ra trong dung dịch hỗn hợp HCl 7,3% và H2SO4 9,8% vừa đủ thu được dung dịch Y. Cô cạn Y thu được bao nhiêu gam chất rắn khan?
A: 59,7 gam
B: 50,2 gam
C: 61,1 gam
D: 51,6 gam
TL:
Mg(NO3)2 ---> MgO + 2NO2 + 1/2O2
x x 2x x/2
Mg(OH)2 ---> MgO + H2O
2x 2x 2x
MgCO3 ---> MgO + CO2
3x 3x 3x
Theo định luật bảo toàn khối lượng ta có: tổng khối lượng của (NO2 + O2 + CO2 + H2O) = 22,08 hay 46.2x + 16x + 44.3x + 18.2x = 22,08. Tính ra x = 0,08 mol.
Như vậy tổng số mol MgO = 6x = 0,48 mol.
MgO + 2HCl ---> MgCl2 + H2O
MgO + H2SO4 ---> MgSO4 + H2O
Gọi a là khối lượng của muối thu được sau phản ứng. Ta có khối lượng dung dịch của (HCl + HSO4) = a + m(H2O - m(MgO) = a + 18.0,48 - 40.0,48 = a - 10,56.
Số mol HCl = 0,073.(a-10,56)/36,5 = u; số mol H2SO4 = 0,098.(a-10,56)/98 =v.
Mà u/2 + v = 0,48 nên a = 247,227 g.
Đúng 0
Bình luận (0)
Cho 1,5 gam hỗn hợp (X) gồm Mg và MgO tác dụng với axit HCl dư, thu được 336cm³ khí H₂ (đktc). Thành phần phầm trăm của mỗi chất trong (X) là bao nhiêu ? Biết H 1 ; O 16 ; Mg 24 ; Cl 35,5. 24% Mg và 76% MgO. 50% Mg và 50% MgO. 25% Mg và 75% MgO. 30% Mg và 70% MgO.
Đọc tiếp
Cho 1,5 gam hỗn hợp (X) gồm Mg và MgO tác dụng với axit HCl dư, thu được 336cm³ khí H₂ (đktc). Thành phần phầm trăm của mỗi chất trong (X) là bao nhiêu ? Biết H = 1 ; O = 16 ; Mg = 24 ; Cl = 35,5. 24% Mg và 76% MgO. 50% Mg và 50% MgO. 25% Mg và 75% MgO. 30% Mg và 70% MgO.
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=0,015(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,015.24}{1,5}.100\%=24\%\\ \Rightarrow \%_{MgO}=100\%-24\%=76\%\)
Chọn A
Đúng 0
Bình luận (0)
\(n_{Mg}=n_{H_2}=\dfrac{0.336}{22.4}=0.015\left(mol\right)\)
\(m_{Mg}=0.015\cdot24=0.36\left(g\right)\)
\(\%Mg=\dfrac{0.36}{1.5}\cdot100\%=24\%\)
\(\%MgO=100-24=76\%\)
Đúng 0
Bình luận (0)