khử (x) gam quặng manhetit ( chứa 95% fe3o4 , 5% tạp chất trơ) bằng 896ml khí CO(đktc), sau phản ứng thu được chất rắn A và khí B. hiệu suất phản ứng đạt 80%. tính x , mA ,VB

Những câu hỏi liên quan
Đốt cháy 3 gam than chứa 95% cacbon và 5% tạp chất trơ (không tham gia phản ứng) trong trong không khí (dư) thu được bao nhiêu gam khí cacbonic, biết phản hiệu suất phản ứng bằng 80%
\(m_C=3.95\%=2,85g\)
\(n_C=\frac{2,85}{12}=0,2375mol\)
PTHH: \(C+O_2\rightarrow^{t^o}CO_2\)
\(m_{CO_2}=0,2375.44.80\%=8,36g\)
Một loại quặng A chứa 90% fe3o4, còn lại là tạp chất không tham gia phản ứng. Cho khí hidro qua m gam quặng A nung nóng thu được chất rắn B có khối lượng bằng 80% khối lượng quặng ban ban đầu. Tính hiệu suất phản ứngGIÚP MIK VỚI MN ƠI, MIK SẮP THI HU...
Xem chi tiết
Coi :
\(m_A = 232(gam)\\ \Rightarrow n_{Fe_3O_4} = 232.90\% : 232 = 0,9(mol)\\ \text{Gọi hiệu suất phản ứng là a}\Rightarrow n_{Fe_3O_4\ pư} = 0,9a(mol)\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ n_{Fe} = 0,9a.3 = 2,7a(mol)\\ n_{Fe_3O_4\ dư} = 0,9 - 0,9a(mol)\\ m_B = 2,7a.56 + (0,9 - 0,9a).232 = 232.80\%\\ \Rightarrow a = 0,4028 = 40,28\%\)
Đúng 1
Bình luận (0)
Nung m gam thuốc tím chứa 10% tạp chất ( không phản ứng ) thu được 10,08 lít khí (đktc) thu được hỗn hợp chất rắn X.
Tính m biết hiệu suất phản ứng ( H bằng 80%) tính % khối lượng các chất trong hỗn hợp X
Đầu tiên phải đổi về số mol đã:
PTHH: 2 KMnO4
K2MnO4 + MnO2 + O2
pt 2 1 1 1
Mol 0,9 0,45 0,45 0,45
Hp/ứ = 80% m KMnO4 ban đầu =
nKMnO4 ban đầu = 177,75: 158 = 1,125 mol
nKMnO4 dư= 1,125 – 0,9 = 0,225 mol.
Thuốc tím có lẫn 10% tạp chất
m thuốc tím =
Khối lượng chất rắn sau phản ứng: 197,5 – 0,45.32 = 183,1 gam
Chất rắn sau phản ứng gồm KMnO4 dư, K2MnO4, MnO2, tạp chất.
%MnO2/CR=
%K2MnO4/CR=
Đúng 3
Bình luận (1)
\(n_K=n_{O_2}=\dfrac{V}{22,4}=0,45\left(mol\right)\)
\(PTHH:2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
....................0,9..............................................0,45........
\(\Rightarrow m_{KMnO_4}=n.M=142,2\left(g\right)\)
Mà H = 80 %
\(\Rightarrow m_{KMnO_4tg}=177,75\%\)
Lại có : Trong m g thuốc tím chỉ có 90% phản ứng .
\(\Rightarrow m=197,5\left(g\right)\)
Vậy ...
Đúng 0
Bình luận (0)
Hỗn hợp chất rắn A gồm FeCO3, FeS2 và tạp chất trơ. Hỗn hợp khí B gồm 20% oxi và 80% nitơ về thể tích. Cho hỗn hợp A vào bình kín dung tích 10 lít ( không đổi) chứa lượng hỗn hợp B vừa đủ. Nung nóng bình cho các phản ứng xảy ra hoàn toàn, các phản ứng cùng tạo ra một oxit sắt, oxit này phản ứng với dung dịch HNO3 dư không tạo ra khí. Sau phản ứng, đưa nhiệt độ bình về 136,50C, trong bình còn lại chất rắn X và hỗn hợp khí Y. Tỉ khối của Y so với H2 bằng 17 và áp suất trong bình là P atm. Cho dòng...
Đọc tiếp
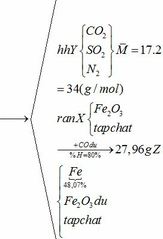
Hỗn hợp chất rắn A gồm FeCO3, FeS2 và tạp chất trơ. Hỗn hợp khí B gồm 20% oxi và 80% nitơ về thể tích. Cho hỗn hợp A vào bình kín dung tích 10 lít ( không đổi) chứa lượng hỗn hợp B vừa đủ. Nung nóng bình cho các phản ứng xảy ra hoàn toàn, các phản ứng cùng tạo ra một oxit sắt, oxit này phản ứng với dung dịch HNO3 dư không tạo ra khí. Sau phản ứng, đưa nhiệt độ bình về 136,50C, trong bình còn lại chất rắn X và hỗn hợp khí Y. Tỉ khối của Y so với H2 bằng 17 và áp suất trong bình là P atm. Cho dòng khí CO dư đi qua X đun nóng, biết rằng chỉ xảy ra phản ứng khử oxit sắt thành kim loại và đạt hiệu suất 80%.Sau phản ứng thu được 27,96 gam chất rắn Z, trong đó kim loại chiếm 48,07% khối lượng.
(a) Tính giá trị của P ( coi thể tích chất rắn X là rất nhỏ) và thành phần % khối lượng tạp chất trong A.
(b) Cho Y phản ứng với oxi ( dư) có V2O5 ( xúc tác) ở 4500C, hấp thụ sản phẩm vào 592,8 gam nước, được dung dịch C ( D = 1,02 gam/ml). Tính nồng độ mol của dung dịch C. Giả thiết hiệu suất của quá trình là 100%.
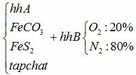
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
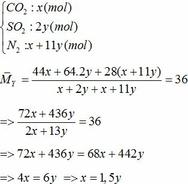
Khối lượng Fe có trong Z là:
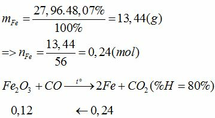
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
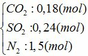
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
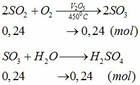
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
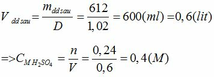
Đúng 0
Bình luận (0)
Cho 10,8 gam Al vào dung dịch HCl dư sau khi phản ứng xảy ra hoàn toàn thu được V lít H2 (đktc)
a, Tính V
b, Nếu dẫn khí H2 trên qua ống nghiệm đựng 29 gam chất rắn Fe3O4 sau khi kết thúc phản ứng thu được 22,6 gam chất rắn. Tính hiệu suất phản ứng?
a) \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,4---------------------->0,6
=> V = 0,6.22,4 = 13,44 (l)
b)
\(n_{Fe_3O_4}=\dfrac{29}{232}=0,125\left(mol\right)\)
Gọi số mol Fe3O4 pư là a (mol)
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
Xét tỉ lệ: \(\dfrac{0,125}{1}< \dfrac{0,6}{4}\) => Hiệu suất tính theo Fe3O4
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
a----------------->3a
=> 232(0,125-a) + 56.3a = 22,6
=> a = 0,1
=> \(H\%=\dfrac{0,1}{0,125}.100\%=80\%\)
Đúng 2
Bình luận (0)
nAl = 10,8 : 27 = 0,4 (mol)
pthh : Al + 6HCl-t--> AlCl3 + H2
0,4--->2,4 (mol)
=> V= VO2 = 2,4 . 22,4 = 53,76 ( l)
nFe3O4 = 29 : 232 = 0,125 (mol)
pthh Fe3O4 + 4H2 -t--> 3Fe+ 4H2O
0,125----------------->0,375 (mol)
nFe (tt ) = 22,6 : 56 = 0,403 (mol )
%H = 0,375 / 0,403 . 100 % = 93 %
Đúng 1
Bình luận (0)
Cho một luồng khí H2 (lấy dư) qua ống sứ đựng 10 gam quặng hemantit được đốt nóng ở nhiệt độ cao, sau khi phản ứng kết thúc, lấy chất rắn còn lại trong ống sứ đem hòa tan trong dung dịch HCl (lấy dư) thì thu được 2,24 lít khí H2 (đktc). Cho rằng quặng hemantit chứa Fe2O3 và các tạp chất coi như trơ. a) Tính phần trăm khối lượng Fe2O3 có trong quặng b) Cần bao nhiêu tấn quặng hemantit nói trên để sản xuất được 1 tấn gang chứa 96% sắt? Biết hiệu suất của quá trình là 80%.
Đọc tiếp
Cho một luồng khí H2 (lấy dư) qua ống sứ đựng 10 gam quặng hemantit được đốt nóng ở nhiệt độ cao, sau khi phản ứng kết thúc, lấy chất rắn còn lại trong ống sứ đem hòa tan trong dung dịch HCl (lấy dư) thì thu được 2,24 lít khí H2 (đktc). Cho rằng quặng hemantit chứa Fe2O3 và các tạp chất coi như trơ.
a) Tính phần trăm khối lượng Fe2O3 có trong quặng
b) Cần bao nhiêu tấn quặng hemantit nói trên để sản xuất được 1 tấn gang chứa 96% sắt? Biết hiệu suất của quá trình là 80%.
a. nH2 = nFe = 0,1mol
Bảo toàn nguyên tố Fe => nFe2O3 = 0,05mol
=> mFe2O3 = 8g
=> %Fe2O3 = (8:10) . 100% = 80%
Đúng 0
Bình luận (0)
Nung m gam một loại quặng canxit chứa a% về khối lượng tạp chất trơ, sau một thời gian thu được 0,78m gam chất rắn, hiệu suất của phản ứng nhiệt phân là 80%. Giá trị của a là A. 37,5. B. 67,5. C. 62,5. D. 32,5.
Đọc tiếp
Nung m gam một loại quặng canxit chứa a% về khối lượng tạp chất trơ, sau một thời gian thu được 0,78m gam chất rắn, hiệu suất của phản ứng nhiệt phân là 80%. Giá trị của a là
A. 37,5.
B. 67,5.
C. 62,5.
D. 32,5.
Nung a gam thuốc tím (chứa 20% tạp chất trơ) đến khi có 8,4 lít khí oxi (đktc) thoát ra thì ngừng nung, biết hiệu suất của phản ứng đạt 80%. Tính a?
Ta có: \(n_{O_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4\left(LT\right)}=2n_{O_2}=0,75\left(mol\right)\)
Mà: H = 80% \(\Rightarrow n_{KMnO_4\left(TT\right)}=\dfrac{0,75}{80\%}=0,9375\left(mol\right)\)
\(\Rightarrow m_{KMnO_4\left(TT\right)}=0,9375.158=148,125\left(g\right)\)
Mà: Thuốc tím chứa 20% tạp chất trơ.
\(\Rightarrow a=\dfrac{148,125}{80\%}=185,15625\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 7: 1. Khử 34,8g Fe3O4 bằng khí H2 dư. Tính khối lượng chất rắn thu được sau phản ứng biết hiệu suất của phản ứng đạt 90%.2. Nung 20g hỗn hợp Al, Mg, Zn trong không khí dư. Sau khi phản ứng kết thúc thu được 29,6g hỗn hợp chất rắn A. Cho A tác dụng với lượng dư H2SO4.a. Viết PTHH xảy rab. Tính khối lượng muối sunfat thu được sau phản ứngc. Nếu cho toàn bộ kim loại trên tác dụng với dung dịch HCl dư hãy tính thể tích khí H2 thu được ở đktc
Đọc tiếp
Câu 7:
1. Khử 34,8g Fe3O4 bằng khí H2 dư. Tính khối lượng chất rắn thu được sau phản ứng biết hiệu suất của phản ứng đạt 90%.
2. Nung 20g hỗn hợp Al, Mg, Zn trong không khí dư. Sau khi phản ứng kết thúc thu được 29,6g hỗn hợp chất rắn A. Cho A tác dụng với lượng dư H2SO4.
a. Viết PTHH xảy ra
b. Tính khối lượng muối sunfat thu được sau phản ứng
c. Nếu cho toàn bộ kim loại trên tác dụng với dung dịch HCl dư hãy tính thể tích khí H2 thu được ở đktc
\(n_{Fe_3O_4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
\(pthh:Fe_3O_4+H_2\underrightarrow{t^o}Fe+H_2O\)
0,15 0,15
=> \(m_{Fe}=\dfrac{90.0,15}{100}.56=7,56\left(g\right)\)
Đúng 0
Bình luận (0)
Câu 7 :
1) \(n_{Fe3O4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
Pt : \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O|\)
1 4 3 4
0,15 0,45
\(n_{Fe}=\dfrac{0,15.3}{1}=0,45\left(mol\right)\)
\(m_{Fe\left(Lt\right)}=0,45.56=25,2\left(g\right)\)
⇒ \(m_{Fe\left(tt\right)}=25,2.90\%=22,68\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)




















