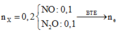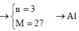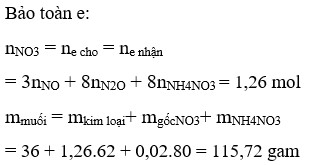Có một hỗn hợp khí B gồm N2O , NO có dB/H2 = 18,5. Tính % V, % n, % m của hỗn hợp B.

Những câu hỏi liên quan
Hỗn hợp Y gồm NO và N2O; tỉ khối của Y so với H2 là 18,5 và thể tích của Y là 4,48 (l). Tính số mol mỗi khí trong hỗn hợp Y
Gọi x,y là số mol của NO và N2O
\(\left\{{}\begin{matrix}x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\30x+44y=18,5.2.0,2=7,4\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Hoà tan a gam Al trong dung dịch HNO3 loãng thu được 0,896 lít hỗn hợp khí X gồm N2O và NO (đktc). Tỷ khối hơi của X so với H2 bằng 18,5.
a. Tính % khối lượng các khí trong hỗn hợp ?
\(\left\{{}\begin{matrix}n_{N_2O}+n_{NO}=0,04\\44n_{N_2O}+30n_{NO}=18,5.2.0,04=1,48\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{N_2O}=0,02\left(mol\right)\\n_{NO}=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{N_2O}=\dfrac{0,02.44}{1,48}.100\%=59,46\%\\\%m_{NO}=\dfrac{0,02.30}{1,48}.100\%=40,54\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Lấy 9,9 gam kim loại M có hoá trị không đổi đem hoà vào HNO3 loãng dư thu được 4,48 lít hỗn hợp khí X ( ở ĐKTC) gồm hai khí NO và N2O, tỉ khối của khí X đối với H2 bằng 18,5. Vậy kim loại M là A. Zn B. Al C. Mg D. Ni
Đọc tiếp
Lấy 9,9 gam kim loại M có hoá trị không đổi đem hoà vào HNO3 loãng dư thu được 4,48 lít hỗn hợp khí X ( ở ĐKTC) gồm hai khí NO và N2O, tỉ khối của khí X đối với H2 bằng 18,5. Vậy kim loại M là
A. Zn
B. Al
C. Mg
D. Ni
Cho 9,9 gam kim loại M có hóa trị không đổi đem hoà vào hno3 loãng dư thu được 4,48 l hỗn hợp khí X gồm no và n2o, tỉ khối hơi của khí X đối với h2 bằng 18,5. Tìm kim loại M
Mhh khí=37g/mol
=>mhh khí=37.0,2=7,4g
nhh khí=0,2 mol
Gọi nNO=x mol nN2O=y mol
=>x+ y=0,2 mol
Và 30x+44y=7,4=>x=y=0,1 mol
N+5 +3e =>N+2
0,3 mol<=0,1 mol
2N+5. +2.4e =>2N+1
0,8 mol<=0,2 mol
Tổng n e nhận=1,1 mol=n e nhường
GS kl M hóa trị n
M =>M+n. +ne
1,1/n mol<= 1,1 mol
=>1,1M=9,9n=>M=9n=>chọn n=3=>M=27 Al
Đúng 0
Bình luận (0)
Cho 36 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 1lít dung dịch
H
N
O
3
1,6M, thu được dung dịch chứa m gam muối và 4,48 lít hỗn hợp khí X (đktc) gồm NO và
N
2
O
. Tỉ khối của X so với
H
2
là 18,5. Giá trị của m là A. 114,12 B. 115,72 C. 98,75 D. 113,5
Đọc tiếp
Cho 36 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 1lít dung dịch H N O 3 1,6M, thu được dung dịch chứa m gam muối và 4,48 lít hỗn hợp khí X (đktc) gồm NO và N 2 O . Tỉ khối của X so với H 2 là 18,5. Giá trị của m là
A. 114,12
B. 115,72
C. 98,75
D. 113,5
Hoà tan hoàn toàn 5,94g kim loại R trong dung dịch HNO3 loãng thu được 2,688 lít (đktc) hỗn hợp khí gồm NO và N2O có tỷ khối so với H2 là 18,5. Kim loại R là: A. Fe. B. Cu. C. Mg. D. Al
Đọc tiếp
Hoà tan hoàn toàn 5,94g kim loại R trong dung dịch HNO3 loãng thu được 2,688 lít (đktc) hỗn hợp khí gồm NO và N2O có tỷ khối so với H2 là 18,5. Kim loại R là:
A. Fe.
B. Cu.
C. Mg.
D. Al
Đáp án D
Gọi n là số oxi hóa của M trong sản phẩm tạo thành.
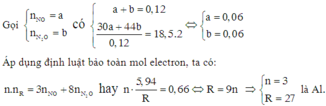
Đúng 0
Bình luận (0)
Hỗn hợp M gồm
A
l
,
A
l
2
O
3
,
F
e
3
O
4
,
C
u
O
,
F
e
v
à
C
u
trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 nung...
Đọc tiếp
Hỗn hợp M gồm A l , A l 2 O 3 , F e 3 O 4 , C u O , F e v à C u trong đó oxi chiếm 20,4255%
khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 nung nóng, sau một thời gian thu được hỗn hợp rắn N và hỗn hợp khí X có tỉ khối so với H 2 bằng 18. Hòa tan toàn bộ N trong lượng dư dung dịch H N O 3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có N H 4 N O 3 ) và 4,48 lít (đktc) hỗn hợp khí Z gồm N O v à N 2 O . Tỉ khối của Z so với H 2 là 16,75Giá trị của m là
A. 96,25
B. 117,95
C. 80,75
D. 139,50
Đáp án B
Trong, đặt ![]()
![]()
![]()
=> giải hệ có x = y = 0,15 mol
![]()
![]()
![]()
![]()
![]()
![]()
![]() giải hệ có: a = 0,15 mol; b = 0,05 mol
giải hệ có: a = 0,15 mol; b = 0,05 mol
![]()
![]()
= 0,45 mol
![]()
Đúng 0
Bình luận (0)
Cho 0,9 mol Al tan hết trong dung dịch HNO3 dư thu được V lít (đktc) hỗn hợp khí X gồm NO và N2O có tỉ khối hơi so với H2 là 20,25 (sản phẩm khử của N+5 chỉ có NO và N2O). Giá trị của V là A. 13,44. B. 8,96. C. 11,2. D. 6,72.
Đọc tiếp
Cho 0,9 mol Al tan hết trong dung dịch HNO3 dư thu được V lít (đktc) hỗn hợp khí X gồm NO và N2O có tỉ khối hơi so với H2 là 20,25 (sản phẩm khử của N+5 chỉ có NO và N2O). Giá trị của V là
A. 13,44.
B. 8,96.
C. 11,2.
D. 6,72.
Đáp án B
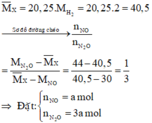
Sơ đồ phản ứng:
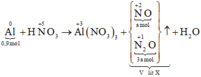
Các quá trình nhường, nhận electron:
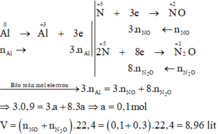
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 19 gam hỗn hợp Cu,Al,Mg ( có tỉ lệ mol 1:2:3) bằng dung dịch HNO3 loãng dư thu được dung dịch Z chứa m gam muối và 4,48 lít (đktc) hỗn hợp khí Y gồm NO và NO2. Biết tỉ khối hơi của hỗn hợp khí Y so với H2 là 18,5. Giá trị của m là bao nhiêu?
Mọi người giúp đỡ mình với ạ ~
Gọi số mol của Cu là a => nAl= 2a, nMg= 3a
mCu+mAl+mMg = 19 => a=0,1 =>nCu=0,1(mol);nAl=0,2(mol);nMg=0,3(mol)
dY/H2 =18,5 => M(Y)= 37 (dùng pp đường chéo) => nNO=nN2O
n(Y)= \(\dfrac{4,48}{22,4}\) =0,2 (mol)
Suy ra: nNO=nN2O= 0,1 (mol)
nNH4NO3 =\(\dfrac{\text{0,1.2+0,2.3+0,3.2−0,1.3−0,1.8 }}{8}\)=0,0375 (mol) bảo toàn e nhe
mm′ = mCu(NO3)2+ mAl(NO3)3 +mMg(NO3)2+mNH4NO3 = 108,8(g) ( khúc này bảo toàn nguyên tố Cu,Al,Mg => số mol của muối Cu2+,Al3+,Mg2+ )
Đúng 0
Bình luận (0)