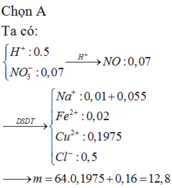Cho 20 gam CaCo3 vào 200ml dung dịch HCl 3M. Số mol chất còn dư sau phản ứng là.

Những câu hỏi liên quan
Cho 20 gam CaC O 3 vào 200 ml dung dịch HCl 3M. Số mol chất còn dư sau phản ứng là
A. 0,4 mol
B. 0,2 mol
C. 0,3 mol
D. 0,25 mol
Cho 5,4 gam nhôm và 175 gam dung dịch HCL 14,6% sau phản ứng chất nào còn dư dư bao nhiêu gam.b Tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng 2. Hòa tan 4,2 gam mg vào 200ml dung dịch HCl a. tính thể tích h2 thoát ra điều kiện tiêu chuẩn b.tính nồng độ mol của dung dịch HCL cần dùng
1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M
Đúng 0
Bình luận (0)
Cho một dòng khí H2 qua ống chứa 20,8 gam hỗn hợp MgO, CuO đun nóng thu được 1,08 gam hơi nước, trong ống còn lại chất rắn B. Cho B vào 200ml dung dịch HCl 3M, sau phản ứng lọc bỏ phần không tan thu dược dung dịch C. Thêm vào dung dịch C lượng Fe dư thu được 1,12 lít khí ở đktc, lọc bỏ phần rắn thu được dung dịch D. Cho NaOH dư và dung dịch D rồi đun trong không khí cho phản ứng hoàn toàn thu được kết tủa E. Khối lượng của E là A. 27 gam B. 27,1 gam C. 27,2 gam D. 27,3 gam
Đọc tiếp
Cho một dòng khí H2 qua ống chứa 20,8 gam hỗn hợp MgO, CuO đun nóng thu được 1,08 gam hơi nước, trong ống còn lại chất rắn B. Cho B vào 200ml dung dịch HCl 3M, sau phản ứng lọc bỏ phần không tan thu dược dung dịch C. Thêm vào dung dịch C lượng Fe dư thu được 1,12 lít khí ở đktc, lọc bỏ phần rắn thu được dung dịch D. Cho NaOH dư và dung dịch D rồi đun trong không khí cho phản ứng hoàn toàn thu được kết tủa E. Khối lượng của E là
A. 27 gam
B. 27,1 gam
C. 27,2 gam
D. 27,3 gam
Tóm tắt quá trình phản ứng:
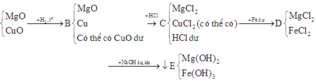
Toàn bộ các phản ứng có thể xảy ra:
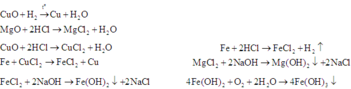
* Đầu tiên, ta xét xem trong hỗn hợp B có CuO dư hay không.
n H C l b a n đ ầ u = 0 , 6 ; n H C l p h ả n ứ n g v ớ i F e = 2 n H 2 ⇒ n H C l p h ả n ứ n g v ớ i B = 0,6 - 0,1 = 0,5
Nếu B không có CuO dư, khi đó trong B chi có MgO phản ứng với HCl.
Khi đó m M g O = 1 2 n H C l p h ả n ứ n g v ớ i B = 0 , 25 ⇒ m M g O = 10 ( g a m )
Mặt khác n C u ( B ) = n H 2 O = 0 , 06
Nếu B không có CuO, tức là CuO trong hỗn hợp ban đầu bị khử hết thì nCuO = nCu = 0,06
![]()
Vậy trong hỗn hợp B có CuO dư.
* Sau khi xác định chính xác thành phần của các hỗn hợp, chúng ta bắt đầu tính toán theo yêu cầu đề bài.
Hỗn hợp B có m M g O + m C u O = m B - m C u = ( m B + m O g i ả m ) - ( m C u + m O g i ả m ) = m b a n đ ầ u - m C u O b ị H 2 k h ử = 16 ( g a m )

Đáp án C.
Đúng 0
Bình luận (0)
Cho 20gam CaCO3 vào 200 ml dung dịch HCl 3M. Số mol khí thu được sau phản ứng là:
A. 0,6 mol.
B. 0,2 mol.
C. 0,4mol.
D. 0,5mol.
\(n_{CaCO_3}=\dfrac{20}{100}=0.2\left(mol\right)\)
\(n_{HCl}=0.2\cdot3=0.6\left(mol\right)\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
Lập tỉ lệ :
\(\dfrac{0.2}{1}< \dfrac{0.6}{2}\) \(\Rightarrow HCldư\)
\(n_{CO_2}=n_{CaCO_3}=0.2\left(mol\right)\)
Đúng 2
Bình luận (0)
Cho m gam bột đồng dư vào bình chứa dung dịch chứa 0,5 mol HCl, 0,01 mol NaNO3 và 0,02 mol Fe(NO3)3 Sau khi phản ứng kết thúc thấy, cho tiếp dung dịch NaNO3 dư vào bình thu được 1,65 gam khí NO và còn 0,16 gam chất rắn không tan trong bình. Biết các phản ứng xảy ra hoàn toàn và NO là sản phẩm khử duy nhất của N+5. Giá trị m là A. 12,8 gam B. 6,4 gam C. 19,2 gam D. 16 gam
Đọc tiếp
Cho m gam bột đồng dư vào bình chứa dung dịch chứa 0,5 mol HCl, 0,01 mol NaNO3 và 0,02 mol Fe(NO3)3 Sau khi phản ứng kết thúc thấy, cho tiếp dung dịch NaNO3 dư vào bình thu được 1,65 gam khí NO và còn 0,16 gam chất rắn không tan trong bình. Biết các phản ứng xảy ra hoàn toàn và NO là sản phẩm khử duy nhất của N+5. Giá trị m là
A. 12,8 gam
B. 6,4 gam
C. 19,2 gam
D. 16 gam
cho 200ml dung dịch NaOH 0,5M vào 300ml dung dịch H2SO4 1,5M theo pt:
2NaOH + H2SO4 -> Na2SO4 + 2H2O
A. chất nào còn dư sau phản ứng có khối lượng bao nhiêu
B. tính nồng độ mol các chất tan trong dung dịch sau phản ứng
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\cdot0,5=0,1\left(mol\right)\\n_{H_2SO_4}=0,3\cdot1,5=0,45\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,45}{1}\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{Na_2SO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{Na_2SO_4}}=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
200ml = 0,2l
300ml = 0,3l
Số mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,5.0,2=0,1\left(mol\right)\)
Số mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1,5.0,3=0,45\left(mol\right)\)
Pt : 2NaOH + H2SO4 → Na2SO4 + 2H2O\(|\)
2 1 1 2
0,1 0,45 0,05
a) Lập tỉ số so sánh : \(\dfrac{0,1}{2}< \dfrac{0,45}{1}\)
⇒ NaOH phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của NaOH
Số mol dư của dung dịch axit sunfuric
ndư= nban đầu - nmol
= 0,45 - \(\left(\dfrac{0,1.1}{2}\right)\)
= 0,4 (mol)
Khối lượng dư của dung dịch xxit sunfuric
mdư = ndư . MH2SO4
= 0,4. 98
= 39,2 (g)
b) Số mol của natri sunfat
nNa2SO4= \(\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng= 0,2 + 0,3
= 0,5 (l)
Nồng độ mol của natri sunfat
CMNa2SO4 = \(\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Nồng độ mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,4}{0,5}=0,8\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Hòa tan 2,32 gam oxit sắt từ Fe3O4 trong 200ml dung dịch HCl 1M thu được dung dịch X
a) Viết phương trình phản ứng hóa học.
b) Sau phản ứng. chất nào phản ứng hết? Chất nào còn dư
c) Tính nồng độ mol mỗi chất trong dung dịch X
Cho 24 gam fe2 o3 vào 200 ml dung dịch h2so4 2,5M a, hãy tính số mol các chất đã cho trước phản ứng B, tính số mol chất còn dư ( nếu có) sau phản ứng C, tính nồng độ mol của dung dịch sau phản ứng biết thể tích dung dịch thay đổi không đáng kể
a) $n_{Fe_2O_3} = \dfrac{24}{160} = 0,15(mol)$
$n_{H_2SO_4} =0,2.2,5 = 0,5(mol)$
b)
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Vì :
$n_{Fe_2O_3} : 1 < n_{H_2SO_4} : 3$ nên $H_2SO_4$ dư
$n_{H_2SO_4\ pư} = 3n_{Fe_2O_3} = 0,45(mol)$
$n_{H_2SO_4\ dư} = 0,5 - 0,45 = 0,05(mol)$
c)
$n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = 0,15(mol)$
$C_{M_{Fe_2(SO_4)_3}} = \dfrac{0,15}{0,2} = 0,75M$
$C_{M_{H_2SO_4}} = \dfrac{0,05}{0,2} = 0,25M$
Đúng 2
Bình luận (0)
Cho 5,6 gam sắt tác dụng 300ml dung dịch HCl 1M.
a. Chất nào còn dư trong phản ứng trên ? tính khối lượng chất dư?
b. Tính nồng độ mol các chất còn lại sau phản ứng? (giả sử thể tích dung dịch không đổi)
\(300(ml)=0,3(l)\\ n_{HCl}=1.0,3=0,3(mol);n_{Fe}=\dfrac{5,6}{56}=0,1(mol)\\ a,PTHH:Fe+2HCl\to FeCl_2+H_2\\ \text{LTL: }\dfrac{n_{Fe}}{1}<\dfrac{n_{HCl}}{2}\Rightarrow HCl\text{ dư}\\ \Rightarrow n_{HCl(dư)}=0,3-0,1.2=0,1(mol)\\ \Rightarrow m_{HCl(dư)}=0,1.36,5=3,65(g)\\ b,n_{FeCl_2}=n_{Fe}=0,1(mol)\\ \Rightarrow \begin{cases} C_{M_{FeCl_2}}=\dfrac{0,1}{0,3}=0,33M\\ C_{M_{HCl(dư)}}=\dfrac{0,1}{0,3}=0,33M \end{cases}\)
Đúng 1
Bình luận (0)