Cân bằng các phản ứng sau theo 4 bước:
S+HNO3 thu đượcH2SO4+NO2+H2O
NH3+Cl2 thu được N2 + HCl
Câu 1: Cân bằng phản ứng oxi hóa khử sau theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hóa, sự oxi hóa, sự khử:
(1) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
(2) HNO3 + Cu→ Cu(NO3)2 + NO2 + H2O 80
(3) NH3 + O2 NO + H2O
(1) \(K\overset{+7}{Mn}O_4+H\overset{-1}{Cl}\rightarrow KCl+\overset{+2}{Mn}Cl_2+\overset{0}{Cl_2}+H_2O\)
- Chất khử: HCl
Chất oxh: KMnO4
- Sự oxh: \(2Cl^{-1}\rightarrow Cl_2^0+2e|\times5\)
Sự khử: \(Mn^{+7}+5e\rightarrow Mn^{+2}|\times2\)
\(\rightarrow2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
(2) \(H\overset{+5}{N}O_3+\overset{0}{Cu}\rightarrow\overset{+2}{Cu}\left(NO_3\right)_2+\overset{+4}{N}O_2+H_2O\)
- Chất khử: Cu
Chất oxh: HNO3
- Sự khử: \(N^{+5}+1e\rightarrow N^{+4}|\times2\)
Sự oxh: \(Cu^0\rightarrow Cu^{+2}+2e|\times1\)
\(\rightarrow4HNO_3+Cu\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\)
(3) \(\overset{-3}{N}H_3+\overset{0}{O_2}\rightarrow\overset{+2}{N}\overset{-2}{O}+H_2O\)
- Chất khử: NH3
Chất oxh: O2
- Sự khử: \(O_2^0+4e\rightarrow2O^{-2}|\times5\)
Sự oxh: \(N^{-3}\rightarrow N^{+2}+5e|\times4\)
\(\rightarrow4NH_3+5O_2\rightarrow4NO+6H_2O\)
cân bằng phản ứng oxi hóa - khử theo phương pháp thăng bằng electron 1H2SO4+H2S->S+H2O
2 s+HNO3->H2SO4+NO
3I2+HNO3->HIO3+NO+H2O
4 NH3+O2->No+H2O
5 C+HNO3->NO2+CO2+H2O
6H2SO4+HI->I2+H2S+H2O
7P+KClO3->P2O5+KCl
8 NH3+CuO->Cu+H2O+N2
Cân bằng các phản ứng sau theo phương pháp electron:
1. SO2 + H2S \(\rightarrow\) S + H2O
2. Al + Fe3O4 \(\rightarrow\) Al2O3 + Fe
3. SO2 + Cl2 + H2O \(\rightarrow\) H2SO4 + HCl
4. MnO2 + HCl \(\rightarrow\) MnCl2 + Cl2 + H2O
5. Cu + HNO3 \(\rightarrow\) Cu(NO3)2 + NO2 + H2O
6. Mg + H2SO4(n) \(\rightarrow\) MgSO4 + S + H2O
7*. FeSO4 + KMnO4 + H2SO4 \(\rightarrow\) Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
8*. H2S + KMnO4 + H2SO4 \(\rightarrow\) MnSO4 + K2SO4 + S\(\downarrow\) + H2O
cân bằng phương trình sau bằng cách thăng bằng electron:
Fe2O3 + HNO3 → Fe(NO)3 + NO2 + H2O
Al + HNO3 → Al(NO3)3 + N2 + H2O
K2Cr2O7 + HCl → CrCl3 + Cl2 + H2O
FexOy + HNO3 → Fe(NO)3 + NO2 + H2O
Bạn xem lại PT 1 và 3 nhé.
\(\overset{0}{Al}+H\overset{+5}{N}O_3\rightarrow\overset{+3}{Al}\left(NO_3\right)_3+\overset{0}{N_2}+H_2O\)
\(\overset{0}{Al\rightarrow}\overset{+3}{Al}+3e|\times10\)
\(2\overset{+5}{N}+10e\rightarrow\overset{0}{N_2}|\times3\)
⇒ 10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
\(\overset{^{+2y/x}}{Fe_x}O_y+H\overset{+5}{N}O_3\rightarrow\overset{+3}{Fe}\left(NO_3\right)_3+\overset{+4}{N}O_2+H_2O\)
\(\overset{^{+2y/x}}{Fe_x}\rightarrow x\overset{+3}{Fe}+\left(3x-2y\right)e|\times1\)
\(\overset{+5}{N}+e\rightarrow\overset{+4}{N}|\times\left(3x-2y\right)\)
⇒ FexOy + (6x-2y)HNO3 → xFe(NO3)3 + (3x-2y)NO2 + (3x-y)H2O
Xác định chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử và cân bằng phản ứng sau:
1. NH3 + Cl2 → N2 + HCl
2. P + H2SO4 → H3PO4 + SO2+ H2O
3. HNO3 + P → H3PO4+ NO2+ H2O
4. H2S + O2 → S + H2O
5. Al + H2SO4 đặc nóng → Al2(SO4)3 + S + H2O
6. Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O
7. Al + HNO3 ® Al(NO3)3 + N2 + H2O
8. KMnO4 + PH3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O
9. KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O
10. FeO + HNO3 ® Fe(NO3)3 + NxOy + H2O
Cân bằng các phương trình phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
b) HNO3 + HCl → NO + Cl2 + H2O.
c) HClO3 + HCl → Cl2 + H2O.
d) PbO2 + HCl → PbCl2 + Cl2 + H2O
Cân bằng các phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
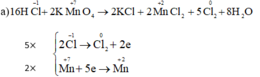
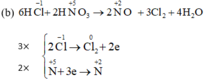
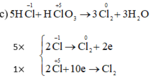
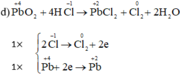
Cân bằng các phản ứng oxi hóa khử sau ( theo phương pháp thăng bằng electron ) và chỉ rõ chất khử , chất oxi hóa , quá trình khử , quá trình oxi hóa :
K2CrO7+HCL -) KCL+CrCl3+Cl+H2O
P+H2SO4 -) H3PO4+SO2+H2O
MnO2+HCL -) MnCl2+Cl+H2O
Cu+HNO3 -) Cu(NO3)+NO2+H2O
Mg+H2SO4 -) MgSO4+S+H2O
HNO3+H2S -) S+NO+H2O
NH3+CuO -) Cu+N2+H2O
Al+HNO3 -) Al(NO3)3+NO2+H2O
Al+HNO3 -) Al(NO3)3+NO+H2O
1)\(K_2Cr_2O_7+HCl\rightarrow KCl+CrCl_3+Cl_2+H_2O\)
Có\(\left\{{}\begin{matrix}3\times|2Cl^{-1}\rightarrow Cl_2+2e\left(1\right)\\2\times|Cr^{+6}+3e\rightarrow Cr^{+3}\left(2\right)\end{matrix}\right.\)
\(\Rightarrow K_2Cr_2O_7+14HCl\rightarrow2CrCl_3+3Cl_2+2KCl+7H_2O\)Trong đó Cr là chất khử và Cl là chất oxi hóa, quá trình (1) là quá trình oxi hóa còn quá trình (2) là quá trình khử
2)\(P^0+H_2S^{+6}O_4\rightarrow H_3P^{+5}O_4+S^{+4}O_2+H_2O\)
Có:\(\left\{{}\begin{matrix}2\times|P^0\rightarrow P^{+5}+5e\left(1\right)\\5\times|S^{+6}+2e\rightarrow S^{+4}\left(2\right)\end{matrix}\right.\)
\(\Rightarrow2P+5H_2SO_4\rightarrow2H_3PO_4+5SO_2+2H_2O\)Trong đó S là chất khử, P là chất oxi hóa, quá trình (1) là quá trình oxi hóa còn quá trình (2) là quá trình khử
3)\(Mn^{+4}O_2+HCl^{-1}\rightarrow Mn^{+2}Cl_2+Cl^0_2+H_2O\)
Có\(\left\{{}\begin{matrix}1\times|Mn^{+4}+2e\rightarrow Mn^{+2}\left(1\right)\\1\times|2Cl^{-1}\rightarrow Cl_2^0+2e\left(2\right)\end{matrix}\right.\)
\(\Rightarrow MnO_2+4HCl\rightarrow MnCl_2+Cl_2+H_2O\)
Mn là chất khử còn Cl là chất oxi hóa, quá trình (1) là quá trình khử còn quá trình (2) là quá trình oxi hóa
4)\(Cu^0+HN^{+5}O_3\rightarrow Cu^{+2}\left(NO_3\right)_2+N^{+4}O_2+H_2O\)Có\(\left\{{}\begin{matrix}1\times|Cu^0\rightarrow Cu^{+2}+2e\left(1\right)\\2\times|N^{+5}+e\rightarrow N^{+4}\left(2\right)\end{matrix}\right.\)
\(Cu+4HNO_3\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\)Cu là chất oxi hóa và N là chất khử, quá trình (1) là quá trình oxi hóa còn quá trình (2) là quá trình khử
5)\(Mg^0+H_2S^{+6}O_4\rightarrow Mg^{+2}SO_4+S^0+H_2O\)
Có\(\left\{{}\begin{matrix}3\times|Mg^0\rightarrow Mg^{+2}+2e\left(1\right)\\1\times|S^{+6}+6e\rightarrow S^0\left(2\right)\end{matrix}\right.\)
\(\Rightarrow3Mg+4H_2SO_4\rightarrow3MgSO_4+S+4H_2O\)
Mg là chất oxi hóa và S là chất khử, quá trình (1) là quá trình oxi hóa và quá trình (2) là quá trình khử
6)\(HN^{+5}O_3+H_2S^{-2}\rightarrow S^0+N^{+2}O+H_2O\)
Có:\(\left\{{}\begin{matrix}2\times|N^{+5}+3e\rightarrow N^{+2}\left(1\right)\\3\times|S^{-2}\rightarrow S^0+2e\left(2\right)\end{matrix}\right.\)
\(\Rightarrow2HNO_3+3H_2S\rightarrow3S+2NO+4H_2O\)
N là chất khử, S là chất oxi hóa, quá trình (1) là quá trình khử, (2) là quá trình oxi hóa
7)\(N^{-3}H_3+Cu^{+2}O\rightarrow Cu^0+N_2^0+H_2O\)
Có\(\left\{{}\begin{matrix}1\times|2N^{-3}\rightarrow N_2^0+6e\left(1\right)\\3\times|Cu^{+2}+2e\rightarrow Cu\left(2\right)\end{matrix}\right.\)
\(\Rightarrow2NH_3+3CuO\rightarrow3Cu+N_2+3H_2O\)
N là chất oxi hóa và Cu là chất khử, quá trình (1) là quá trình oxi hóa và quá trình (2) là quá trình khử
8)\(Al^0+HN^{+5}O_3\rightarrow Al^{+3}\left(NO_3\right)_3+N^{+4}O_2+H_2O\)
Có:\(\left\{{}\begin{matrix}1\times|Al^0\rightarrow Al^{+3}+3e\left(1\right)\\3\times|N^{+5}+1e\rightarrow N^{+4}\left(2\right)\end{matrix}\right.\)
\(\Rightarrow Al+6HNO_3\rightarrow Al\left(NO_3\right)_3+3NO_2+3H_2O\)
Al là chất oxi hóa và N là chất khử, quá trình(1) là quá trình oxi hóa và quá trình (2) là quá trình khử
9)\(Al^0+HN^{+5}O_3\rightarrow Al^{+3}\left(NO_3\right)_3+N^{+2}O+H_2O\)
Có\(\left\{{}\begin{matrix}1\times|Al^0\rightarrow Al^{+3}+3e\left(1\right)\\1\times|N^{+5}+3e\rightarrow N^{+2}\left(2\right)\end{matrix}\right.\)
\(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
Al là chất oxi hóa và N là chất khử, quá trình(1) là quá trình oxi hóa và quá trình (2) là quá trình khử
Cho các phản ứng sau:
(a) 4HCl + P b O 2 → P b C l 2 + C l 2 + 2 H 2 O
(b) HCl + N H 4 H C O 3 → N H 4 C l + C O 2 + H 2 O
(c) 2HCl + 2 H N O 3 → 2 N O 2 + C l 2 + 2 H 2 O
(d) 2HCl + Zn → Z n C l 2 + H 2
Trong các phản ứng trên, số phản ứng trong đó HCl thể hiện tính khử là
A. 3
B. 4
C. 1
D. 2
Chọn đáp án D
Các phản ứng trong đó HCl thể hiện tính khử là:
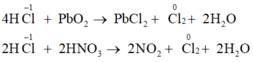
Có các nhận xét sau về N và hợp chất của nó:
1) N2 tương đối trơ về hoạt động hóa học ở điều kiện thường vì trong phân tử có một liên kết ba bền.
2) Khí NH3 tan tốt trong H2O tạo được dung dịch có môi trường bazơ.
3) HNO3 được tạo ra khi cho hỗn hợp khí (NO2 và O2) sục vào H2O.
4) Khi phản ứng với Fe2O3 thì HNO3 đóng vai trò là chất oxi hóa.
5) Khi sục khí NH3 đến dư vào dung dịch CuSO4 thì sau phản ứng hoàn toàn thu được kết tủa màu xanh.
6) Trong công nghiệp NH3 được tạo ra khi cho N2 phản ứng với H2.
Trong các nhận xét trên số nhận xét đúng là:
A. 2
B. 3
C. 4
D. 5