Viết phương trình phản ứng xảy ra khi cho kim loại Kali vào dung dịch từng chất sau :a/ NaCl ; b/ (NH4)2SO4; c/ Fe2(SO4)3 ; d/ Ca(HCO3)

Những câu hỏi liên quan
Hòa tan hoàn toàn 5,85 g kim loại Kali vào 100 gam H2O. Sau khi phản ứng xảy ra xong thu được dung dịch A và V lít khí thoát ra (đktc). Viết phương trình phản ứng xảy ra, tìm giá trị V và tính nồng độ phần trăm của dung dịch A
\(n_K=\dfrac{5,85}{39}=0,15\left(mol\right)\)
PTHH: 2K + 2H2O --> 2KOH + H2
_____0,15------------->0,15-->0,075
=> VH2 = 0,075.22,4 =1,68(l)
mdd = 5,85 + 100 - 0,075.2 = 105,7(g)
=> \(C\%=\dfrac{0,15.56}{105,7}.100\%=7,95\%\)
Đúng 2
Bình luận (0)
Nêu hiện tượng và viết các phương trình phản ứng xảy ra trong các trường hợp sau: a) Cho đinh sắt sạch vào dung dịch CuSO4. b) Cho mẫu kim loại kali từ từ đến dư vào dung dịch Al2(SO4)3. c) Cho FeS2 vào dung dịch H2SO4 đặc nóng, dư.
Đọc tiếp
Nêu hiện tượng và viết các phương trình phản ứng xảy ra trong các trường hợp sau:
a) Cho đinh sắt sạch vào dung dịch CuSO4.
b) Cho mẫu kim loại kali từ từ đến dư vào dung dịch Al2(SO4)3.
c) Cho FeS2 vào dung dịch H2SO4 đặc nóng, dư.
a) Màu xanh của dung dịch CuSO4 nhạt dần kim loại màu đỏ bám trên đinh sắt:
Fe + CuSO4 → FeSO4 + Cu
b) Có khí không màu thoát ra, có kết tủa keo trắng sau đó kết tủa tan:
K + H2O → KOH + ½ H2
6KOH + Al2(SO4)3 → 2Al(OH)3 + 3Na2SO4
KOH + Al(OH)3 → KAlO2 + 2H2O
c) Chất rắn tan ra, dung dịch có màu vàng nâu và có khí không màu mùi hắc thoát ra:
2FeS2 + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
Đúng 0
Bình luận (0)
Thả 0,975 gam Kali vào 100 ml dung dịch axit axetic, phản ứng xảy ra vừa
đủ. Sau phản ứng thu được chất khí A và dung dịch chứa chất tan B.
a) Viết phương trình của phản ứng hóa học xảy ra. Chất A và B là gì?
b) Tính nồng độ mol của dung dịch axetic đã sử dụng.
c) Tính thể tích khí A (đktc).
Thả 0,975 gam Kali vào 100 ml dung dịch axit axetic, phản ứng xảy ra vừa
đủ. Sau phản ứng thu được chất khí A và dung dịch chứa chất tan B.
a) Viết phương trình của phản ứng hóa học xảy ra. Chất A và B là gì?
b) Tính nồng độ mol của dung dịch axetic đã sử dụng.
c) Tính thể tích khí A (đktc).
a, \(n_K=\dfrac{0,975}{39}=0,025\left(mol\right)\)
A là khí H2, B là CH3COOK
PTHH: 2K + 2CH3COOH → 2CH3COOK + H2
Mol: 0,025 0,025 0,0125
b, \(C_{M_{ddCH_3COOH}}=\dfrac{0,025}{0,1}=0,25M\)
c, \(V_{H_2}=0,0125.22,4=0,28\left(l\right)\)
Đúng 2
Bình luận (0)
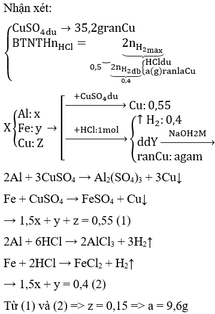
Hỗn hợp X gồm ba kim loại Al, Fe, Cu. Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500 ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.Viết phương trình phản ứng xảy ra và tìm giá trị của a.
Đọc tiếp
Hỗn hợp X gồm ba kim loại Al, Fe, Cu. Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500 ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.Viết phương trình phản ứng xảy ra và tìm giá trị của a.
Cho 17,3 gam hỗn hợp gồm 2 kim loại Al và Zn tác dụng với 400 gam dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn (các chất phản ứng vừa đủ) thì thu được 15,68l H2 (đktc) a. viết phương trình phản ứng xảy ra b.Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu c. Tính C% mỗi muối thu được sau phản ứng
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn. Mặt khác, khi cho hỗn hợp X vào dung dịch CuCl2, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được muối khan. Biết các phản ứng hóa học xảy ra hoàn toàn. Hãy viết các phương trình phản ứng xảy ra.
Đọc tiếp
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn. Mặt khác, khi cho hỗn hợp X vào dung dịch CuCl2, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được muối khan. Biết các phản ứng hóa học xảy ra hoàn toàn.
Hãy viết các phương trình phản ứng xảy ra.
M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓
Đúng 0
Bình luận (0)
Cho hỗn hợp X gồm Al, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2. Sau phản ứng thu được hỗn hợp Y gồm 2 kim loại và dung dịch Z. Cho NaOH dư vào dung dịch Z thu được 2 kết tủa gồm 2 hiđroxit kim loại. Xác định các chất trong hỗn hợp Y và dung dịch Z. Viết các phương trình phản ứng xảy ra
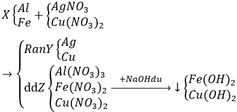
Pt:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓
2Al + 3Cu(NO3)2 → 2Al(NO3)2 + 3Cu↓
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaNO3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
Đúng 0
Bình luận (0)
cho 5,4 gam kim loại nhôm vào dung dịch có chứa 7,3gam axit clohiddric
a)viết phương trình hóa học xảy ra
b)tìm khối lượng của các chất sau khi phản ứng kết thúc
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{0,2}{2}\) > \(\dfrac{0,2}{6}\) ( mol )
1/15 0,2 1/15 0,1 ( mol )
\(m_{AlCl_3}=\dfrac{1}{15}.13,5=8,9g\)
\(m_{H_2}=0,1.2=0,2g\)
\(m_{Al\left(dư\right)}=\left(0,2-\dfrac{1}{15}\right).27=3,6g\)
Đúng 2
Bình luận (0)