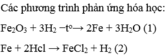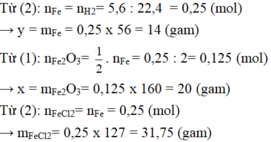có ai có bài tập về phản ứng khử của hiđro vs kim loại ko

Những câu hỏi liên quan
II- BÀI TẬP TỰ LUẬN :Bài 1: Viết phương trình hóa học cho các phản ứng giữa hidro và các oxit sau:a. Sắt (III) oxitb. Thủy ngân (II) oxitc. Chì (II) oxitBài 2: Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:a) Tính số gam đồng kim loại thu được.b) Tính thể tích khí hiđro (đktc) cần dùngBài 3: Khử 21,7 gam thủy ngân(II) oxit bằng hiđro. Hãy:a) Tính số gam thủy ngân thu được.b) Tính số mol và thể tích khí hiđro (đktc) cần dùngBài 4: Tính thể tích oxi (đktc) thu được khi phân hủy 4,9 gam KClO3 trong...
Đọc tiếp
II- BÀI TẬP TỰ LUẬN :
Bài 1: Viết phương trình hóa học cho các phản ứng giữa hidro và các oxit sau:a. Sắt (III) oxitb. Thủy ngân (II) oxitc. Chì (II) oxit
Bài 2: Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính số gam đồng kim loại thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng
Bài 3: Khử 21,7 gam thủy ngân(II) oxit bằng hiđro. Hãy:
a) Tính số gam thủy ngân thu được.
b) Tính số mol và thể tích khí hiđro (đktc) cần dùng
Bài 4: Tính thể tích oxi (đktc) thu được khi phân hủy 4,9 gam KClO3 trong phòng thí
nghiệm?
Bài 5: Tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít oxi (các thể tích đo ở đktc).
Bài 6: Cho các kim loại kẽm, nhôm, sắt, lần lượt tác dụng với dung dịch H2SO4 loãng.
a, Viết phản ứng hóa học?
b, Cho cùng một khối lượng kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất?
c, Nêú thu được cùng một thể tích khí H2 thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 7: Dẫn 2,24 lít khí H2 ở đktc vào một ống có chứa 12g CuO đã nung nóng tới nhiệt độ thích hợp. Kết thúc phản ứng trong ống còn a(g) chất rắn.
a. Viết phương trình phản ứng.
b. Tính khối lượng nước tạo thành sau phản ứng trên.
c. Tính a.
3.
nHgO = 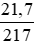
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.
Đúng 1
Bình luận (0)
1.
Phương trình phản ứng:
Fe3O4 + 4H2 → 4H2O + 3Fe
HgO + H2 → H2O + Hg
PbO + H2 → H2O + Pb
Đúng 0
Bình luận (0)
2.
a. Số mol đồng (II) oxit: n = m/M = 48/80 = 0,6 (mol)
Phương trình phản ứng:
CuO + H2 to→ H2O + Cu
1 mol 1 mol 1 mol
0,6 0,6 0,6
Khối lượng đồng kim loại thu được: m = n.M = 0,6.64 = 38,4 (g)
b. Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.n = 22,4.0,6 = 13,44 (lít).
Đúng 0
Bình luận (1)
Xem thêm câu trả lời
Cho các phát biểu sau: (1) Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh (2) Khí clo oxi hóa trực tiếp được hầu hết các kim loại (3) Trong các phản ứng với kim loại và hiđro, clo thể hiện tính khử mạnh (4) Khí clo và khí hiđro phản ứng với nhau trong điều kiện bóng tối (5) Khí clo tan trong nước tạo ra hỗn hợp axit clohiric và axit hipocloro (6) HClO là chất có tính khử mạnh Số phát biểu đúng là: A. 2 B. 1 C. 3 D. 4
Đọc tiếp
Cho các phát biểu sau:
(1) Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh
(2) Khí clo oxi hóa trực tiếp được hầu hết các kim loại
(3) Trong các phản ứng với kim loại và hiđro, clo thể hiện tính khử mạnh
(4) Khí clo và khí hiđro phản ứng với nhau trong điều kiện bóng tối
(5) Khí clo tan trong nước tạo ra hỗn hợp axit clohiric và axit hipocloro
(6) HClO là chất có tính khử mạnh
Số phát biểu đúng là:
A. 2
B. 1
C. 3
D. 4
Đáp án C
Các phát biểu đúng: (1); (2); (5)
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (1) Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh (2) Khí clo oxi hóa trực tiếp được hầu hết các kim loại (3) Trong các phản ứng với kim loại và hiđro, clo thể hiện tính khử mạnh (4) Khí clo và khí hiđro phản ứng với nhau trong điều kiện bóng tối (5) Khí clo tan trong nước tạo ra hỗn hợp axit clohiric và axit hipocloro (6) HClO là chất có tính khử mạnh Số phát biểu đúng là: A. 2 B. 1 C. 3 ...
Đọc tiếp
Cho các phát biểu sau:
(1) Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh
(2) Khí clo oxi hóa trực tiếp được hầu hết các kim loại
(3) Trong các phản ứng với kim loại và hiđro, clo thể hiện tính khử mạnh
(4) Khí clo và khí hiđro phản ứng với nhau trong điều kiện bóng tối
(5) Khí clo tan trong nước tạo ra hỗn hợp axit clohiric và axit hipocloro
(6) HClO là chất có tính khử mạnh
Số phát biểu đúng là:
A. 2
B. 1
C. 3
D. 4
Đáp án C
Các phát biểu đúng: (1); (2); (5)
Đúng 0
Bình luận (0)
Người ta dùng khí Hiđro ( đktc) để khử hoàn toàn 16g hỗn hợp CuO và Fe2O3 ( Tỉ lẹ khối lượng hai oxit là 1:1) Sau phản ứng thu được hai kim loại tương ứng .
a) Viết các phướng trình phản ứng xảy ra.
b) Tính khối lượng mỗi kim loại thu được.
c) Để có lượng H2 trên cần bao nhiêu gam kẽm tác dung với axit clohiđric (HCl).
Khử hoàn toàn 3,2 gam sắt (3) oxit = khí hiđro
a) viết pt hóa học của phản ứng
b) tính thể tích khí hiđro (đktc) cần dùng
c) tính khối lượng kim loại sắt thu đc sau phản ứng
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{3,2}{160}=0,02mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,02 0,06 0,04 ( mol )
\(V_{H_2}=n.22,4=0,06.22,4=1,334l\)
\(m_{Fe}=n.M=0,04.56=2,24g\)
Đúng 3
Bình luận (0)
nFe2O3 = 3,2/160 = 0,02 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
Mol: 0,02 ---> 0,06 ---> 0,04
VH2 = 0,06 . 22,4 = 1,344 (l)
mFe = 0,04 . 56 = 2,24 (g)
Đúng 2
Bình luận (0)
nFe2O3 = 3,2:160=0,02 (mol)
a) PTHH : Fe2O3 +3H2 -t--> 2Fe +3H2O
0,02----> 0,06------->0,04(mol)
b) VH2= 0,06.22,4=1,344(l)
c) mFe = 0,04 .56=2,24(g)
Đúng 1
Bình luận (0)
Bài tập 1: Viết PTHH thể hiện:
a/ Sự oxi hoá các chất: Cu, Al, C2H4, CO, Fe, Mg, S.
b/ Hiđro khử các chất: Fe3O4, Fe2O3, O2, HgO,PbO. Và cho biết chúng thuộc phản ứng hoá học nào?
Bài tập 2: Phân loại và gọi tên các chất có CTHH: CuO, P2O5, Cr2O3, Cl2O7, Na2O, MgO, Fe2O3, Al2O3, SO3, N2O, CO.
\(2Cu+O_2\underrightarrow{t^o}2CuO\\
4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\
C_2H_4+4O_2\underrightarrow{t^o}2CO_2+4H_2O\\
2CO+O_2\underrightarrow{t^o}2CO_2\\
3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\
2Mg+O_2\underrightarrow{t^o}2MgO
\\
S+O_2\underrightarrow{t^O}SO_2\)
B)
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\\
Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\
2H_2+O_2\underrightarrow{t^o}2H_2O\\
HgO+H_2\underrightarrow{t^o}Hg+H_2O\\
PbO+H_2\underrightarrow{t^o}Pb+H_2O\)
Đúng 2
Bình luận (1)
Bài 1:
a, \(Cu+\dfrac{1}{2}O_2\underrightarrow{t^o}CuO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(CO+\dfrac{1}{2}O_2\underrightarrow{t^o}CO_2\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(Mg+\dfrac{1}{2}O_2\underrightarrow{t^o}MgO\)
\(S+O_2\underrightarrow{t^o}SO_2\)
b, \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(O_2+2H_2\underrightarrow{t^o}2H_2O\)
\(HgO+H_2\underrightarrow{t^o}Hg+H_2O\)
\(PbO+H_2\underrightarrow{t^o}Pb+H_2O\)
Bạn tự chỉ ra loại pư nhé!
Đúng 1
Bình luận (1)
Bài 2:
CuO: oxit bazơ - Đồng (II) oxit
P2O5: oxit axit - Điphotpho pentaoxit.
Cr2O3: oxit lưỡng tính - Crom (III) oxit.
Cl2O7: oxit axit - Điclo heptaoxit
Na2O: oxit bazơ - Natri oxit.
MgO: oxit bazơ - Magie oxit.
Fe2O3: oxit bazơ - Sắt (III) oxit.
Al2O3: oxit lưỡng tính - Nhôm oxit.
SO3: oxit axit - Lưu huỳnh trioxit.
N2O: oxit axit - Đinitơ monooxit.
CO: oxit trung tính - Cacbon monooxit.
Bạn tham khảo nhé!
Đúng 1
Bình luận (1)
Để điều chế khí hiđro người ta cho 97,5 g kim loại kẽm phản ứng hoàn toàn với dung dịch axit clohiđric.
a) Viết phương trình phản ứng xảy ra.
b) Tính thể tích khí hiđro tạo thành (ở đktc).
c) Nếu dùng lượng khí hiđro trên để khử 120g Fe2O3. Sau phản ứng chất nào còn dư? Dư bao nhiêu gam hay lít?
a, nZn = 97,5/65 = 1,5 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
nH2 = nZn = 1,5 (mol)
VH2 = 1,5 . 22,4 = 33,6 (l)
b, nFe2O3 = 120/160 = 0,75 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,75 > 1,5/3 => Fe2O3 dư
nFe2O3 (p/ư) = 1,5/3 = 0,5 (mol)
mFe2O3 (dư) = (0,75 - 0,5) . 160 = 40 (g)
Đúng 2
Bình luận (1)
a. \(n_{Zn}=\dfrac{97.5}{65}=1,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
1,5 1,5
b. \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c. \(n_{Fe_2O_3}=\dfrac{120}{160}=0,75\left(mol\right)\)
PTHH : Fe2O3 + 3H2 -> 2Fe + 3H2O
0,5 1,5
Ta thấy \(\dfrac{0.75}{1}>\dfrac{1.5}{3}\) => Fe2O3 dư
\(m_{Fe_2O_3\left(dư\right)}=\left(0,75-0,5\right).160=40\left(g\right)\)
\(V_{Fe_2O_3\left(dư\right)}=0,5.22,4=11,2\left(l\right)\)
Đúng 0
Bình luận (3)
Cho các từ và cụm từ: oxi, khử, nhẹ nhất, oxit axit, oxit bazơ, nguyên tố, hiđro, kim loại, hiđroxit, gốc axit. Điền từ thích hợp vào chỗ trống:(a) Khí hiđro là chất khí nhẹ nhất trong các khí, có phản ứng nổ với ........... , ……… được cac oxit kim loại thành kim loại.(b) …………………. là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.(c) Nước là hợp chất tạo bởi hai ……………… là ………….. và …………. Nước tác dụng với m...
Đọc tiếp
Cho các từ và cụm từ: oxi, khử, nhẹ nhất, oxit axit, oxit bazơ, nguyên tố, hiđro, kim loại, hiđroxit, gốc axit. Điền từ thích hợp vào chỗ trống:
(a) Khí hiđro là chất khí nhẹ nhất trong các khí, có phản ứng nổ với ........... , ……… được cac oxit kim loại thành kim loại.
(b) …………………. là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
(c) Nước là hợp chất tạo bởi hai ……………… là ………….. và …………. Nước tác dụng với một số ……………….. ở nhiệt độ thường và một số ……………….. tạo ra bazơ; tác dụng với nhiều ……………… tạo ra axit.
(d) Axit là hợp chất mà phân tử gồm có một hay nhiều ………………. liên kết với ……………………
Các nguyên tử hiđro này có thể thay thế bằng ……………………..
(e) Bazơ là hợp chất mà phân tử có một ………………… liên kết với một hay nhiều nhóm …………..
a. nguyên tố; hiđrô; oxi; kim loại; oxit bazơ; oxit axit.
d. nguyên tử hiđrô;gốc axit.
Đúng 1
Bình luận (2)
Dùng khí hiđro dư để khử x gam sắt(III) oxit, sau phản ứng người ta thu được y gam sắt kim loại. Nếu dùng lượng sắt này cho phản ứng hoàn toàn với axit clohiđric có dư thì thu được 5,6 lít khí hiđro đo ở điều kiện tiêu chuẩn.
a) Viết các phương trình phản ứng hóa học.
b) Hãy xác định giá trị x, y và lượng muối sắt(II) clorua tạo thành sau phản ứng.