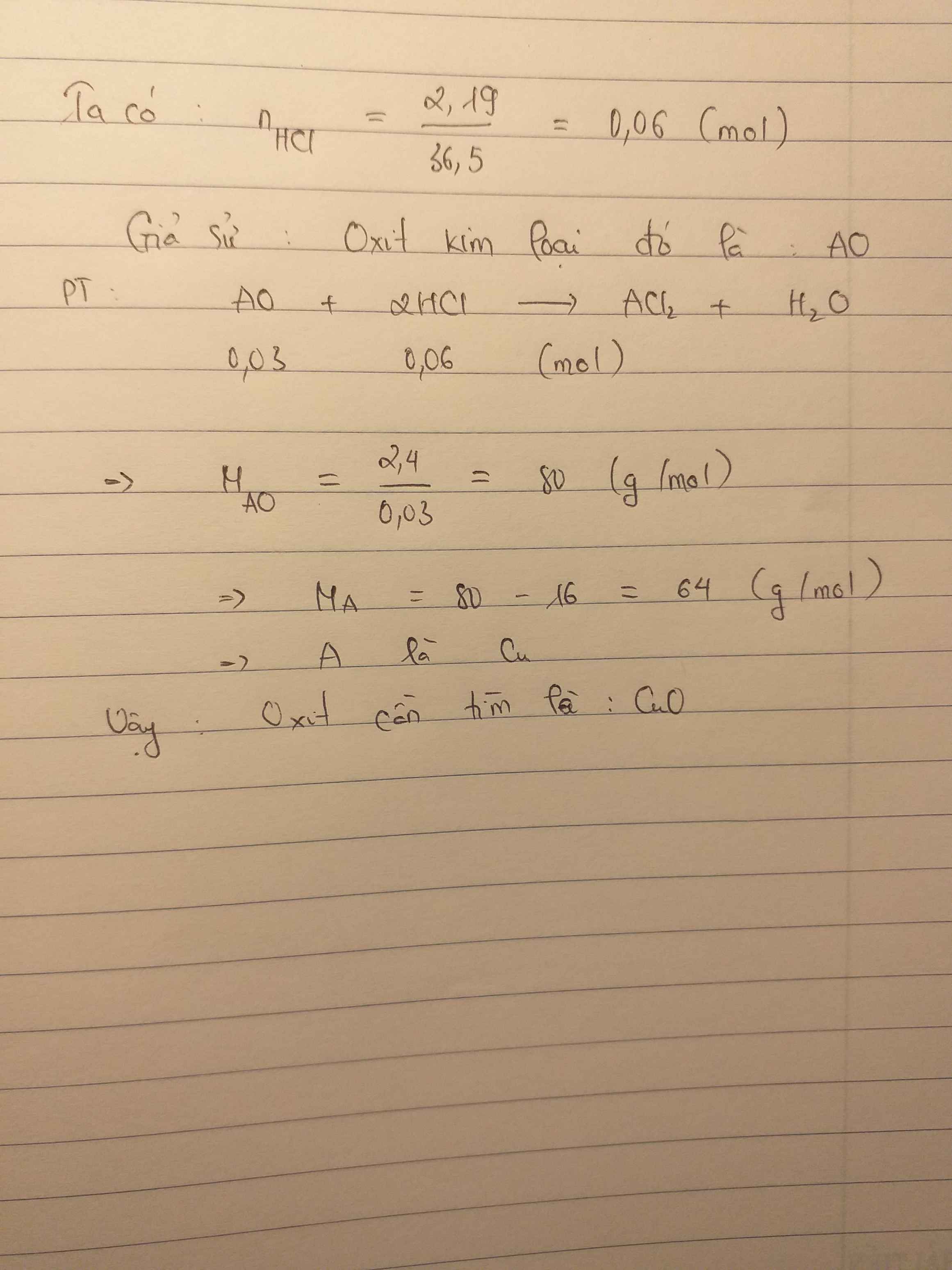cho 2,4g 1 oxit kim loại hóa trị II vào 10g dd HCl 21%. tìm KL của oxit

Những câu hỏi liên quan
Để hòa tan hoàn toàn 2,4g một oxit kim loại hóa trị II cần dùng 10g dd HCl 21,9% . Hỏi đó là oxit của kim loại nào?(chi tiết)
Gọi CTHH của oxit kim loại là RO
\(m_{HCl}=\dfrac{10.21,9\%}{100\%}=2,19\left(g\right)\\ n_{HCl}=\dfrac{2,19}{36,5}=0,06\left(mol\right)\\ RO+2HCl\xrightarrow[]{}RCl_2+H_2O\\ n_{RO}=\dfrac{0,06}{2}=0,03\left(mol\right)\\ M_{RO}=\dfrac{2,4}{0,03}=80\left(g/mol\right)\\ M_R=80-16=64\left(g/mol\right)\\ \Rightarrow R.là.đồng,Cu\)
Đúng 3
Bình luận (0)
Để hòa tan 2,4g oxit của 1 kim loại hóa trị II cần 2,19g axit HCl tìm công thứ oxit kim loại đã dùng
bài1 ; Hòa tan hoàn toàn 18g một KL M cần dung 800ml dd HCl 2,5M. Kim loại M là KL nào?
bài 2 ; Hòa tan hoàn toàn 1 lượng oxit KL hóa trị II vào 1 lượng vừa đủ dd H2SO4 20% tạo thành một dd muối có nồng độ 22,6%. Hãy xác định oxit kim loại
Để hoà tan hoàn toàn 2,4g oxit kim loại hoá trị II cần dùng 10g dd HCl 21,9% Hỏi đó là kim loại nào
Gọi kim loại hóa trị II là A
AO + 2HCl => ACl2 + H2O
mHCl = 10x21.9/100 = 2.19 (g)
==> nHCl = m/M = 2.19/36.5 = 0.06 (mol)
Theo pt ==> nAO = 0.03 (mol)
Ta có: A + 16 = m/n = 2.4/0.03 = 80
==> A = 80-16 = 64 (Cu)
Đúng 0
Bình luận (0)
Để hòa tan 2,4g một oxit của kim loại(II) cần dùng 10g dung dịch HCl 21,9%. Đó là oxit của kim loại nào ?
hòa tan 9,4g M2O vào H2O được dd A có tính kiềm. chia thành 2 phần = nhau
- cho p1 vào 95ml dd HCl 1M thu đc dd làm xanh quỳ tím
- p2 cho vào 105ml dd HCl 1M thu được dd làm đỏ quỳ tím
xác định ct của oxit ban đầu
Đúng 0
Bình luận (0)
Để hòa tan 2,4g một oxit của kim loại(II) cần dùng 10g dung dịch HCl 21,9%. Đó là oxit của kim loại nào ?
XO+2HCl=XCl2+H2O
nHCl=0,06mol. =>nXO=0,03=>Mxo=80=>MX=64
CuO
Đúng 0
Bình luận (3)
Gọi kim loại cần tìm là R
Theo đề, R có hóa trị II => oxit của kim loại là RO
Theo đề ta có PTHH:
RO + 2HCl \(\xrightarrow[]{}\) RCl2 + H2O
Theo đề, mHCl = 10. 21,9%= 2,19 (g)
=> nHCl = \(\dfrac{2,19}{36,5}=0,06\left(mol\right)\)
Theo PTHH:
nRO= \(\dfrac{1}{2}\)nHCl= \(\dfrac{1}{2}\times0,06=0,03\left(mol\right)\)
=> MRO= \(\dfrac{2,4}{0,03}=80\) (g/mol)
Ta có: MRO= MR + 16 =80 (g/mol)
=> MR= 80- 16= 64 (g)
=> R là đồng (Cu)
Vậy kim loại cần tìm là Cu
Đúng 0
Bình luận (2)
Để hòa tan 2,4g một oxit của kim loại(II) cần dùng 10g dung dịch HCl 21,9%. Đó là oxit của kim loại nào ?
m(HCl)= 10*21.9/100= 2.19g
=> n(HCl)= 2.19/36.5=0.06 mol
Gọi kim loại đó là R ta có
RO + 2HCl => R(Cl)2 + H2O
0.03 <-- 0.06mol
=> M(RO)= 2.4/0.03= 80=> R= 80-16= 64
=> R là Cu
Đúng 0
Bình luận (0)
Bài 7.Cho 16,2g kẽm oxit tác dụng với 100g dung dịch axit sunfuric 40%.Tính nồng độ phần trăm các chất có trong dung dịch sau khi pư kết thúc
Bài 8.Để hòa tan hoàn toàn 2,4g oxit kim loại hóa trị II cần dùng 10g dung dịch HCL 21,9%.Hỏi đó là oxit của kim loại nào?
Giúp mình với!Mình đang cần gấp
Bài 7:
Ta có: \(n_{ZnO}=\dfrac{16,2}{81}=0,2\left(mol\right)\)
\(m_{H_2SO_4}=100.40\%=40\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{40}{98}=\dfrac{20}{49}\left(mol\right)\)
PT: \(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{\dfrac{20}{49}}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{ZnSO_4}=n_{H_2SO_4\left(pư\right)}=n_{ZnO}=0,2\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{20}{49}-0,2=\dfrac{51}{245}\left(mol\right)\)
Ta có: m dd sau pư = 16,2 + 100 = 116,2 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,2.161}{116,2}.100\%\approx27,71\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{\dfrac{51}{245}.98}{116,2}.100\%\approx17,56\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Bài 8:
Gọi oxit cần tìm là AO.
Ta có: \(m_{HCl}=10.21,9\%=2,19\left(g\right)\Rightarrow n_{HCl}=\dfrac{2,19}{36,5}=0,06\left(mol\right)\)
PT: \(AO+2HCl\rightarrow ACl_2+H_2O\)
Theo PT: \(n_{AO}=\dfrac{1}{2}n_{HCl}=0,03\left(mol\right)\)
\(\Rightarrow M_{AO}=\dfrac{2,4}{0,03}=80\left(g/mol\right)\)
\(\Rightarrow M_A+16=80\Rightarrow M_A=64\left(g/mol\right)\)
→ A là Cu.
Vậy: Đó là oxit của đồng.
Đúng 2
Bình luận (0)
1.Hòa tan 4g ZnO vào 150g dd HCl 3,65%.Tính C% dd thu được sau phản ứng
2.Cho 15,3g oxit của kim loại hóa trị II vào nước thu đc dd bazo nồng độ 8,55%.Xác định công thức oxit trên