Cho 7,1g Al tác dụng vừa đủ với V ml dd H2SO4 loãng 0,05M; tạo ra khí H2 và Al2(SO4)3
a. Viết PTHH b. Tính V. c. Tính V H2

Những câu hỏi liên quan
Hòa tan hỗn hợp gồm FeO, Fe2O3 và F3O4 (có số mol bằng nhau) bằng dd H2SO4 20% (lượng axit lấy dư 50% so với lượng phản ứng vừa đủ), thu được dd A. Chia A thành bốn phần bằng nhau, mỗi phần có khối lượng 79,3 gam. Phần I tác dụng vừa đủ với V1 ml dung dịch KMnO4 0,05M. Phần II tác dụng vừa đủ với V2 ml dd brom 0,05M. Phần III tác dụng vừa đủ với V3 ml dd HI 0,05M. Cho Na2CO3 từ từ đến dư vào phần IV được V4 lít khí và m gam kết tủa. Giả thiết các phản ứng xảy ra hoàn toàn. Các thể tích khí đo ở...
Đọc tiếp
Hòa tan hỗn hợp gồm FeO, Fe2O3 và F3O4 (có số mol bằng nhau) bằng dd H2SO4 20% (lượng axit lấy dư 50% so với lượng phản ứng vừa đủ), thu được dd A. Chia A thành bốn phần bằng nhau, mỗi phần có khối lượng 79,3 gam. Phần I tác dụng vừa đủ với V1 ml dung dịch KMnO4 0,05M. Phần II tác dụng vừa đủ với V2 ml dd brom 0,05M. Phần III tác dụng vừa đủ với V3 ml dd HI 0,05M. Cho Na2CO3 từ từ đến dư vào phần IV được V4 lít khí và m gam kết tủa. Giả thiết các phản ứng xảy ra hoàn toàn. Các thể tích khí đo ở đktc. Xác định các giá trị V1, V2, V3, V4.
m dd A = 4 . 79,3 = 317,2g
Qui đổi hỗn hợp FeO, Fe2O3, Fe3O4về Fe3O4 có số mol là a
Ta có 232a + (a . 4 . 1,5 . 98) : 0,2 = 317,2
=> a = 0,1 mol
Dd ban đầu
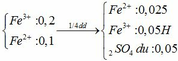
Phần 1:
8H2SO4 + 2KMnO4 + 10FeSO4 → 5Fe2(SO4)3 + 8H2O + 2MnSO4 + K2SO4
0,05 0,025
=> FeSO4 phản ứng hết
=> nKMnO4 = 0,005mol
=> V1= 0,1 lít = 100ml
Phần 2:
2Fe2+ + Br2 → 2Fe3+ + 2Br-
0,025 0,0125
=> V2 = 0,25 lít = 250ml
Phần 3:
2Fe3+ + 2I- → 2Fe2+ + I2
0,05 0,05
=> V3 = 1 lít = 1000ml
Phần 4:
Fe2+ + CO32- → FeCO3↓
0,025 0,025 0,025
2Fe3+ + 3CO32- + 3H2O → 2Fe(OH)3 + 3CO2
0,05 0,075 0,05 0,075
2H+ + CO32- →CO2 + H2O
0,1 0,05 0,05
=> nCO2 = 0,125
=> V4 = 2,8 lít
m kết tủa = mFeCO3 + mFe(OH)3 = 8,25g
Đúng 0
Bình luận (0)
Cho 7,1g Al tác dụng vừa đủ với 500 ml dung dịch H2SO4 loãng , tạo ra khí hiđro và nhôm sunfat ( Al2( SO4)3)
a) Viết phương trình hóa học xảy ra ?
b) Tính thể tích khí H2 sinh ra ( ở đktc ) ?
c) Tính nồng độ mol/1 của dung dịch H2SO4 đã cho ?
Biết Al = 27 ; H =1 ; S=32 ; O=16
1/ Tính CM của dd H2SO4 và NaOH? biết rằng 10 ml dd H2SO4 tác dụng vừa đủ với 30 ml dd NaOH . nêu lấy 20 ml dd H2SO4 cho tác dụng với 2,5 g CaCO3 thì Axit còn dưu và lượng dư này tác dụng vừa đủ với 10 ml NaOH
--Nếu lấy 10ml dd H2SO4 trung hòa 30ml NaOH thì vừa hết
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
0,01a -> 0,02a
Mà 0,02a = 0,03b <=> 2a = 3b
--Nếu lấy 20ml H2SO4 tác dụng với 2,5g CaCO3 thì axit dư và lượng dư này tác dụng đủ với 10g dd NaOH
Ta có:
CaCO3 + H2SO4 -> CaSO4 + CO2 + H2O
0,025 -> 0,025
nH2SO4 dư = 0,02a - 0,025
Mà nH2SO4 dư tác dụng vừa hết với 10g dd NaOH thì
2NaOH + H2SO4 -> Na2SO4 + 2H2O
0,01b <-> 0,02a - 0,025
nNaOH = 2nH2SO4 => 0,04a - 0,05 = 0,01b <=> 4a - 5 = b
<=> 4a - b = 5
=> a = 1,5, b = 1
Vậy CM H2SO4 là 1,5M
CM NaOH là 1M
Đúng 0
Bình luận (0)
n H+ = 2n h2so4 + nHCl= 2*0,02y+ 0,005=0,04y+ 0,005 mol
n OH- =n Naoh= 0,03x
=> 0,03x=0,04y+0,005<=> 0,03x-0,04y=0,005(2)
tư(1) và (2) có hẹ pt, giải he ta đuọc x=1,1M, y=0,7M
Đúng 0
Bình luận (0)
hòa tan 10 8g 1 kim loại hóa trị 3 tác dụng vừa đủ với V ml dd H2SO4 2M (loãng), thu đc 13,44 lít khí H2 (đktc) và m gam muối
Cho mình hỏi đề yêu cầu tính gì vậy bạn ?
Đúng 0
Bình luận (1)
Cho 200 ml dd NaOH 2M tác dụng vừa đủ với V ml dd H2SO4 1M,thu đc dd chỉ có muối trung hòa.hãy tìm giá trị V
Xem chi tiết
Đổi: \(200ml=0,2l\)
\(n_{NaOH}=C_{M_{NaOH}}\cdot V_{dd_{NaOH}}=2\cdot0,2=0,4mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+4H_2O\)
\(0,4----0,2---\left(mol\right)\)
Theo phương trình: \(n_{NaOH}=2n_{H_2SO_4}=0,4mol\Rightarrow n_{H_2SO_4}=0,2mol\)
\(V_{dd_{H_2SO_4}}=\dfrac{n_{H_2SO_4}}{C_{M_{H_2SO_4}}}=\dfrac{0,2}{1}=0,2l=200ml\)
Đúng 2
Bình luận (0)
Cho a gam hh Al và Fe tác dụng hết vs dd H2SO4 loãng, vừa đủ , giải phóng 2,464 lít khí và dd Y có chứa 14,44g muối
A)tính khối lượng mỗi kim loại
B) dd Y tác dụng dd BaCl2 dư thu x gam kết tủa, còn nếu cho tác dụng vs dd NaOH vừa đủ tạo b gam kết tỉa .tính giá trị x,b=?
\(n_{H_2}=\dfrac{2,464}{22,4}=0,11mol\)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow Muối\left\{{}\begin{matrix}Al_2\left(SO_4\right)_3\\FeSO_4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}BTe:3x+2y=2n_{H_2}=0,22\\\dfrac{x}{2}\cdot342+y\cdot152=14,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04mol\\y=0,05mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,04\cdot27=1,08g\\m_{Fe}=0,05\cdot56=2,8g\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_4\downarrow\)
0,02 0,06
\(FeSO_4+BaCl_2\rightarrow BaSO_4\downarrow+FeCl_2\)
0,05 0,05
\(\Rightarrow\Sigma n_{\downarrow}=0,06+0,05=0,11\Rightarrow m_{BaSO_4}=x=25,63g\)
Đúng 1
Bình luận (0)
Cho m gam hh X gồm 2 kim loại Fe, Cu tác dụng vừa đủ với dd axit H2So4 loãng thua được 3360 ml đktc . Cũng hòa tan hh m gam X đó vào H2So4 đẵ nóng thu được 4480 ml đktc A. tính KL m B. Tính V h2So4 0,5 M đã dùng
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{3360}{1000.22,4} = 0,15(mol)$
$n_{SO_2} = \dfrac{4480}{22,4.1000} = 0,2(mol)$
Bảo toàn electron :
$3n_{Fe} + 2n_{Cu} = 2n_{SO_2}$
Suy ra: $0,15.3 + 2n_{Cu} = 0,2.2 \Rightarrow n_{Cu} = -0,025<0$
(Sai đề)
Đúng 1
Bình luận (0)
: Cho 11 gam hỗn hợp hai kim loại Al và Fe tác dụng vừa đủ với V ml dd H2SO4 0,2M, sau phản ứng thu được dung dịch X và khí Y. Cho dung dịch X tác dụng vừa đủ với dung dịch NaOH 10%, thì khối lượng kết tủa lớn nhất thu được là 24,6 gam.a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?b/ Tính V?c/ Tính khối lượng dung dịch NaOH cần dùng ở trên?d/ Đem kết tủa nung ngoài không khí đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
Đọc tiếp
: Cho 11 gam hỗn hợp hai kim loại Al và Fe tác dụng vừa đủ với V ml dd H2SO4 0,2M, sau phản ứng thu được dung dịch X và khí Y. Cho dung dịch X tác dụng vừa đủ với dung dịch NaOH 10%, thì khối lượng kết tủa lớn nhất thu được là 24,6 gam.
a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b/ Tính V?
c/ Tính khối lượng dung dịch NaOH cần dùng ở trên?
d/ Đem kết tủa nung ngoài không khí đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
\(a,\) Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\)
\(\Rightarrow 27x+56y=11(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ Al_2(SO_4)_3+6NaOH\to 2Al(OH)_3\downarrow+3Na_2SO_4\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{Al(OH)_3}=x;n_{Fe(OH)_2}=y\\ \Rightarrow 78x+90y=24,6(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,1(mol) \end{cases} \Rightarrow \begin{cases} m_{Al}=0,2.27=5,4(g)\\ m_{Fe}=11-5,4=5,6(g) \end{cases}\)
\(b,\Sigma n_{H_2SO_4}=1,5x+y=0,4(mol)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{0,4}{0,2}=2(l)\\ c,\Sigma n_{NaOH}=3x+2y=0,8(mol)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{0,8.40}{10\%}=320(g)\\ d,2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\\ Fe(OH)_2\xrightarrow{t^o}FeO+H_2O\\ \Rightarrow n_{Al_2O_3}=0,1(mol);n_{FeO}=0,1(mol)\\ \Rightarrow m_{\text{chất rắn}}=0,1.102+0,1.72=17,4(g)\)
Đúng 1
Bình luận (0)
cho 3,51g hỗn hợp E gồm al và ag tác dụng hoàn toàn và vừa đủ với V ml dd hno3 loãng, thu được 448 ml lít(đktc) khí NO là sản phẩm khử duy nhất
a) Viết PTHH xảy ra
b) tính %khối lượng mỗi kim loại trong E và tính giá trị v
\(3Ag+4HNO_3\rightarrow3AgNO_3+NO+2H_2O\)
\(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(NO\) là sản phẩm khử duy nhất.
\(\Rightarrow n_{NO}=\dfrac{0,448}{22,4}=0,02mol\)
Ta có: \(\left\{{}\begin{matrix}27n_{Al}+108n_{Ag}=3,51g\\BTe:3n_{Al}+n_{Ag}=3n_{NO}=0,06\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,01mol\\n_{Ag}=0,03mol\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,01\cdot27}{3,51}\cdot100\%=7,7\%\)
\(\%m_{Ag}=100\%-7,7\%=92,3\%\)
Đúng 1
Bình luận (1)
a, \(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(3Ag+4HNO_3\rightarrow3AgNO_3+NO+2H_2O\)
Đúng 0
Bình luận (0)
b, \(\left\{{}\begin{matrix}\underrightarrow{BTE}3n_{Al}+n_{Ag}=\dfrac{0,448.3}{22,4}=0,06\\\underrightarrow{BTKL}27n_{Al}+108n_{Ag}=3,51\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,01\\n_{Ag}=0,03\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%Al=\dfrac{0,01.27}{3,51}.100\%=7,69\%\\\%Ag=\dfrac{0,03.108}{3,51}.100\%=92,31\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)























