Cho 6,2 g Na2O tác dụng với 73 3,8 gam nước thu được dung dịch A. Tính nồng độ phần trăm trong A

Những câu hỏi liên quan
Cho a gam Na tác dụng với p gam nước thu được dung dịch NaOH có nồng độ x%. Cho b gam Na2O tác dụng với p gam nước cũng thu được dung dịch NaOH có nồng độ x%. Biểu thức p tính theo a, b là: A.
p
3
a
b
31
a
-
32...
Đọc tiếp
Cho a gam Na tác dụng với p gam nước thu được dung dịch NaOH có nồng độ x%. Cho b gam Na2O tác dụng với p gam nước cũng thu được dung dịch NaOH có nồng độ x%. Biểu thức p tính theo a, b là:
A. p = 3 a b 31 a - 32 b
B. p = 9 a b 31 a - 23 b
C. p = 9 a b 23 a - 31 b
D. p = 6 a b 31 a - 23 b
Đáp án : C.
Xét Na : n H 2 = 1 2 n N a = a 46 m o l
Bảo toàn khối lượng :
mdd sau = mNa + m H 2 O – m H 2 = a + p – 2. a 46 (g)
=> C%NaOH = x %
Xét Na2O
=> mdd sau = m N a 2 O + m H 2 O = b + p
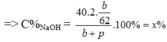
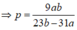
Đúng 0
Bình luận (2)
Cho 6,2 g Na2O tác dụng với nước thu được 0,5 lit dung dịch A a / viết PTHH b/ tính nồng độ mol dd A thu được c/ tính kl dd H2SO4 9,8% cần dùng để trunh hòa dd A nói trên
\(a.Na_2O+H_2O\rightarrow2NaOH\\ b.n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\\ n_{NaOH}=2n_{Na_2O}=0,2\left(mol\right)\\ \Rightarrow CM_{NaOH}=\dfrac{0,2}{0,5}=0,4M\\ c.H_2SO_4+2NaOH\rightarrow Na_2SO_4+H_2O\\ n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,1\left(mol\right)\\ m_{ddH_2SO_4}=\dfrac{0,1.98}{9,8\%}=100\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 8,5 g hỗn hợp Na và Na2O tan hoàn toàn trong 50 gam nước thu được 58,4 gam dung dịch. tính nồng độ phần trăm dung dịch thu được
\(m_{H_2} = 8,5 + 50 - 58,4 = 0,1(gam)\\ n_{H_2} = \dfrac{0,1}{2} = 0,05(mol)\\ 2Na + 2H_2O \to 2NaOH + H_2\\ Na_2O + H_2O \to 2NaOH\\ n_{Na} = 2n_{H_2} = 0,05.2 = 0,1(mol)\\ \Rightarrow n_{Na_2O} = \dfrac{8,5-0,1.23}{62}=0,1(mol)\\ n_{NaOH} = 2n_{Na_2O} + n_{Na} = 0,3(mol)\\ C\%_{NaOH} = \dfrac{0,3.40}{58,4}.100\% = 20,55\%\)
Đúng 1
Bình luận (0)
Bài 6: Cho 21,4 gam Fe(OH)3 tác dụng vừa đủ với 200 gam dung dịch Hydrochloric acid HCl. a) Tính nồng độ phần trăm của dung dịch HCl? b) Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng? Bài 7 : Cho m (g) Zinc oxide ZnO tác dụng vừa đủ 100g dung dịch Sulfuric acid H2SO4 9,8%. a) Tính m b) Tính C% dung dịch muối thu được.
Bài 6:
\(n_{Fe\left(OH\right)_3}=\dfrac{21,4}{107}=0,2\left(mol\right)\)
PT: \(Fe\left(OH\right)_3+3HCl\rightarrow FeCl_3+3H_2O\)
_______0,2________0,6______0,2 (mol)
a, \(C\%_{HCl}=\dfrac{0,6.36,5}{200}.100\%=10,95\%\)
b, \(C\%_{FeCl_3}=\dfrac{0,2.162,5}{21,4+200}.100\%\approx14,68\%\)
Đúng 2
Bình luận (0)
Bài 7:
\(m_{H_2SO_4}=100.9,8\%=9,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PT: \(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
______0,1______0,1_______0,1 (mol)
a, \(m_{ZnO}=0,1.81=8,1\left(g\right)\)
b, \(C\%_{ZnSO_4}=\dfrac{0,1.161}{8,1+100}.100\%\approx14,89\%\)
Đúng 1
Bình luận (0)
Hòa tan 9,3 gam Na2O vào 90,7 gam H2O tạo thành dung dịch A Cho dung dịch A tác dụng với 200 gam dung dịch FeSO4 16% ta thu được kết tủa B và dung dịch C nung kết tủa B đến khối lượng không đổi ta thu được chất rắn D
a) tính nồng độ phần trăm của dung dịch A
b) tính khối lượng chất B và nồng độ phần trăm dung dịch C sau khi bỏ kết tủa B
a/
\(n_{Na_2O}=\dfrac{9,3}{62}=0,15\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,15 0,3 (mol)
\(m_{NaOH}=0,3.40=12\left(g\right)\)
\(m_A=90,7+9,3=100\left(g\right)\)
\(C\%_{NaOH}=\dfrac{12}{100}.100\%=12\%\)
b/
m\(_{FeSO_4}=\dfrac{16.200}{100}=32\left(g\right)\)
\(\rightarrow m_{FeSO_4}=\dfrac{32}{152}=\dfrac{4}{19}\left(mol\right)\)
\(2NaOH+FeSO_4\rightarrow Na_2SO_4+Fe\left(OH\right)_2\downarrow\)
bđ: 0,3 \(\dfrac{4}{19}\) 0 0 (mol)
pư: 0,3 0,15 0,15 0,15 (mol)
dư: 0 \(\dfrac{23}{380}\) (mol)
\(m_{Fe\left(OH\right)_2}=0,15.90=13,5\left(g\right)\)
\(m_C=100+200-13,5=286,5\left(g\right)\)
\(m_{Na_2SO_4}=0,15.142=21,3\left(g\right)\)
\(\rightarrow C\%_{Na_2SO_4}=\dfrac{21,3}{286,5}.100\%\approx7,4\%\)
\(m_{FeSO_4\left(dư\right)}=\dfrac{23}{380}.152=9,2\left(g\right)\)
\(\rightarrow C\%_{FeSO_4\left(dư\right)}=\dfrac{9,2}{286,5}.100\%\approx3,2\%\)
Đúng 2
Bình luận (0)
Cho 6,2 gam Na2O tác dụng với H2O thu được 0.5 lít dung dịch NaOH . a. Tính nồng độ mol của dung dịch NaOH thu được ? b. Tính khối lượng HCl dùng để trung hoà lượng NaOH trên ? ( Cho biết : Na = 23 ; O = 16 ; H = 1 ; Cl = 35,5 ) . .
Cho 6,2 gam Na2O tác dụng với H2O thu được 0.5 lít dung dịch NaOH .
a. Tính nồng độ mol của dung dịch NaOH thu được ?
b. Tính khối lượng HCl dùng để trung hoà lượng NaOH trên ?
( Cho biết : Na = 23 ; O = 16 ; H = 1 ; Cl = 35,5 ) . .
Xem chi tiết
\(n_{Na_2O}=\dfrac{6.2}{62}=0.1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(0.1.........................0.2\)
\(C_{M_{NaOH}}=\dfrac{0.2}{0.5}=0.4\left(M\right)\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(0.2.............0.2\)
\(m_{HCl}=0.2\cdot36.5=7.3\left(g\right)\)
Chúc em học tốt !!!
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4. Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2
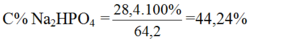
Đúng 0
Bình luận (0)
cho 11,2 gam sắt tác dụng vừa đủ với 200 gam dung dịch HCL. a) tính nồng độ phần trăm của dung dịch HCL. b) tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng?
a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{HCl} =2 n_{Fe} = 0,2.2 = 0,4(mol)$
$C\%_{HCl} = \dfrac{0,4.36,5}{200}.100\% = 7,3\%$
b) $n_{H_2} = n_{FeCl_2} = n_{Fe} = 0,2(mol)
Sau phản ứng, $m_{dd} = 11,2 + 200 - 0,2.2 = 210,8(gam)$
$C\%_{FeCl_2} = \dfrac{0,2.127}{210,8}.100\% = 12,05\%$
Đúng 2
Bình luận (0)


















