khi phân tích hỗn hợp khí A có thành phần % theo khối lượng như sau:
24,2%CO2;48%SO2;15,2%O2 và 12,6%N2.
a)Tính % thể tích mỗi khí có trong hỗn hợp đó
b)Tính tỉ khối của A so với không khí ở cùng điều kiện nhiệt độ,P
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic C O 2 và khí oxi O 2 dư.
Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 0,3. 10 23 phân tử C O 2 và 0,9. 10 23 phân tử O 2 .
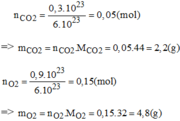
Thành phần % theo khối lượng:
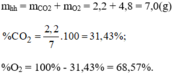
Thành phần % về thể tích:
Sai đề hả? 4(lít) CO2 1, 5(lít) CO2, 7 (lít) N2???
Ở đktc 15,68 lít hỗn hợp khí N2 và khí CO2 có khối lượng là 24,4 g
a) Tính thành phần phần trăm theo thể tích mỗi khí?
b) Tính khối lượng mỗi khí trong hỗn hợp?
a) \(n_{N_2}+n_{CO_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
Có: \(28.n_{N_2}+44.n_{CO_2}=24,4\)
=> \(\left\{{}\begin{matrix}n_{N_2}=0,4\left(mol\right)\\n_{CO_2}=0,3\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{0,4}{0,7}.100\%=57,143\%\\\%V_{CO_2}=\dfrac{0,3}{0,7}.100\%=42,857\%\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}m_{N_2}=0,4.28=11,2\left(g\right)\\m_{CO_2}=0,3.44=13,2\left(g\right)\end{matrix}\right.\)
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic C O 2 và khí oxi O 2 dư.
Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 4g khí cacbonic và 16g khí oxi.
Thành phần theo khối lượng:
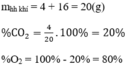
Thành phần phần trăm theo thể tích:

hỗn hợp khí A gồm O2 và CO2 có tỉ khối hơi so với H2 bằng 19,5. Tính thành phần phần trăm theo thể tích và khối lượng mỗi khí trong A.
Gọi số mol O2, CO2 là a, b
Có: \(\overline{M}=\dfrac{32a+44b}{a+b}=19,5.2=39\)
=> \(a=\dfrac{5}{7}b\)
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{a}{a+b}.100\%=\dfrac{\dfrac{5}{7}b}{\dfrac{5}{7}b+b}.100\%=41,67\%\\\%V_{CO_2}=\dfrac{b}{a+b}.100\%=\dfrac{b}{\dfrac{5}{7}b+b}.100\%=58,33\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{O_2}=\dfrac{32a}{32a+44b}.100\%=34,188\%\\\%m_{CO_2}=\dfrac{44b}{32a+44b}.100\%=65,812\%\end{matrix}\right.\)
\(M_{hh}=19,5.M_{H_2}=19,5.2=39\left(\dfrac{g}{mol}\right)\\ Đặt:a=V_{\dfrac{O_2}{hh}}\\ M_{hh}=39\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow\dfrac{32.a+44.\left(100\%-a\right)}{100\%}=39\\ \Leftrightarrow a=\dfrac{5}{12}\\ \Rightarrow\%V_{\dfrac{O_2}{hh}}=\dfrac{5}{12}.100\%=41,667\%\Rightarrow\%V_{\dfrac{CO_2}{hh}}\approx58,333\%\\ \%m_{\dfrac{O_2}{hh}}=\dfrac{\dfrac{5}{12}.32}{\dfrac{5}{12}.32+\dfrac{7}{12}.44}.100\approx34,188\%\\ \Rightarrow\%m_{\dfrac{CO_2}{hh}}\approx65,812\%\)
Hỗn hợp khí A gồm etan và propan. Đốt cháy hỗn hợp A thu được khí CO2 và hơi H2O theo tỷ lệ thể tích 11 : 15. Thành phần % theo khối lượng của các khí có trong A là
A. 18,52% ; 81,48%
B. 45,0%; 55,0%
C. 28,13%;71,87%
D. 25,0%; 75,0%
Đặt nC2H6 = a ; nC3H8 = b ;
Có VCO2 : VH2O = 11 : 15 ⇒ (2a+3b) : (3a+4b) = 11 : 15
⇒ b = 3a
Giả sử nC2H6 =1 ; nC3H8 = 3
⇒ %mC2H6 = 18,52%
%mC3H8 = 81,48%
Đáp án A.
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic C O 2 và khí oxi O 2 dư.
Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 3 mol khí cacbonic và 5 mol khí oxi.
Khối lượng của các khí:
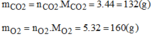
Thành phần phần trăm theo khối lượng:
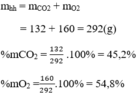
Thành phần phần trăm theo thể tích:
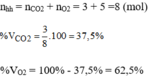
Xác định thành phần phần trăm theo thể tích và theo khối lượng của các khí có trong hỗn hợp gồm: 4,4g khí CO2, 16g khí O2 và 4g khí H2.
1. Khi phân tích một hỗn hợp khí có thành phần phần trăm theo khối lượng như sau 32% SO2 ; 59,6% O2 và 8,4% n2.tính thành phần phần trăm theo thể tích của hỗn hợp khí đó
2. Hỗn hợp gồm Ba(NO3) và Ca3(PO4)2 có khối lượng 116,65g.Trong đó tổng số nguyên tử oxi là 17,4.10^23 nguyên tử.Tính khối lượng của photpho ( P) trong hỗn hợp đó
3. Cho m gam SO3 vào 200g dung dịch H2SO4 14,7% thu được dung dịch H2SO4 20%.Viết PTHH của phản ứng,tính m.