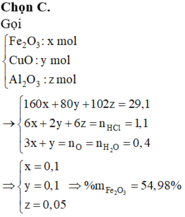hòa tan hoàn toàn 5,5 g hỗn hợp Al và Fe bằng đ HCL 14,6% (d=1,08g/ml) thu được 4,48 l khí H2 (điều kiện tiêu chuẩn)
a)Tính phần trăm về khối lượng mỗi Kim loại
b)Tinh V HCL cần dùng
c)Tinh C% các muối trong dung dịch sau phản ứng