có ai biết giải bài này k mình đang cần rất gấp mong các bạn giúp cho
Bài 1: cho 5,6g oxit của kim loại hóa trị (II) vào nước thu đc 200g dd bazo với nồng độ 3,7%. hãy xác định công thức của oxit trên.
cho 15,3g oxit kim loại hóa trị (2) vào nước thu được 200g dung dịch bazo với nồng độ 8,55%. Hãy xác định công thức của oxit trên
Gọi CTHH của oxit kim loại là RO
\(m_{R\left(OH\right)_2}=8,55\%.200=17,1\left(g\right)\)
Áp dụng định luật BTKL ta có: \(m_{H_2O}=17,1-15,3=1,8\left(g\right)\Rightarrow n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: RO + H2O → R(OH)2
Mol: 0,1 0,1
\(\Rightarrow M_{RO}=\dfrac{15,3}{0,1}=153\left(g/mol\right)\)
⇒ MR = 153 - 16 = 137 (g/mol)
Vậy R là nguyên tố bari (Ba)
1.Hòa tan 4g ZnO vào 150g dd HCl 3,65%.Tính C% dd thu được sau phản ứng
2.Cho 15,3g oxit của kim loại hóa trị II vào nước thu đc dd bazo nồng độ 8,55%.Xác định công thức oxit trên
có ai bt giải bài này không giúp mình vs mk đg cần gấp mong các bạn giúp cho
Bài 1:cho 0,3g một kim loại hóa trị II phản ứng hết vs dd HCl dư, thu đc 0,28lit khí Hidro (ĐKTC) . Xác định tên kim loại .
Bài 2: cho 15g hỗn hợp bột kim loại gồm Zn và Cu vào dd HCl dư, sau khi phản ứng xảy ra hoàn toàn thu đc 4,48lit hidro (ĐKTC) và mgam chất rắn không tan tính hóa trị của m.
Bài 1:
Gọi A là kim loại hóa trị II cần tìm
\(n_{H_2}=\dfrac{0,28}{22,4}=0,0125\left(mol\right)\\ A+2HCl\rightarrow ACl_2+H_2\\ n_A=n_{H_2}=0,0125\left(mol\right)\\ M_A=\dfrac{0,3}{0,0125}=24\left(\dfrac{g}{mol}\right)\)
Vậy: Kim loại A(II) cần tìm là Magie (Mg=24)
Bài 2:
- Chỉ có Zn tác dụng với dd HCl dư chứ Cu thì không.
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{H_2}=0,2\left(mol\right)\\ \rightarrow m_{Zn}=0,2.65=13\left(g\right)\\ \rightarrow m_{Cu}=15-13=2\left(g\right)\\ Vậy:m=2\left(g\right)\)
Cho 15,3 gam oxit của kim loại hoá trị II vào nước thu được 200gam dung dịch bazo với nồng độ 8,55%.Xác định công thức oxit trên
đặt công thức oxit cần tìm là: XO
mX(OH)2= C%*mdd/100=8.55*200/100=17.1g
áp dụng bảo toàn khối lượng: mH2O=17.115.3=1.8g =>nH2O=1.8/18=0.1mol
pt: XO + H2O--> X(OH)2
0.1 0.1
MXO=15.3/0.1=153 g/mol
=> MX= MXO - MO2= 153-16=137
Vậy X là Ba. CTHH của oxit là BaO
Chúc em học tốt!!!:))
các bạn ơi giúp mình với
khi hòa tan một lượng của một oxit kim loại hóa trị 2 vào 1 lượng vừa đủ dung dịch axit H2SO4 4,9% người ta thu được một dung dịch muối có nồng độ 5,78% . Xác định công thức của oxit trên.
mong các bạn giúp đỡ càng nhanh càng tốt ak mình cần gấp lắm, cảm ơn các bạn nhiều!
goi cthh cua oxit hoa tri 2 la MO
MO+H2SO4->MSO4+H2O
goi khoi luong dd H2SO4 la Q ta co
mH2SO4=Q.4,9/100=0,049Q
=nH2SO4=0,049Q/98=0,0005Q
THEO PT nMSO4=nH2SO4=0,0005Q
theo pt nh2s04=nMO=0,0005Q
=>mMSO4=[M+96].0,0005Q=0,0005QM+0,048Q
mddMSO4=[0,0005QM+0,048Q].100/5,78=0,00865QM+0,8304Q[2]
MẶT KHÁC mdd sau pu =Q+0,0005Q[M+16][ 1]
TU 1 va 2 tasuy RA
này bn ơi chỗ này mình làm r nhưng ko bít đúng ko
Cho 15,3 gam oxit của kim loại hoá trị II vào nước thu được 200 gam dung dịch bazơ với nồng độ 8,55%. Hãy xác định công thức của oxit trên.
Cách 1: Đặt công thức hoá học của oxit là MO ⇒ công thức bazơ là M OH 2
MO + H 2 O → M OH 2
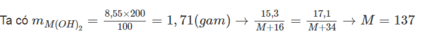
→ Công thức oxit là BaO.
Cách 2: m H 2 O ( p / u ) = m M OH 2 - m MO = 17,1 - 15,3 = 1,8(g)
MO + H 2 O → M OH 2
![]()
Công thức oxit là BaO
Cho 15,3 g Oxit của 1 kim loại có hóa trị II vào nước thu được 200g dd Bazo có C% là 8,55 %.Hãy tìm CT và tên kim loại
Gọi CTHH của oxit kim loại hóa trị II là MO
MO + H2O ------> M(OH)2
\(\frac{15,3}{M+16}\) --------------> \(\frac{15,3}{M+16}\)(mol)
C%(dd bazơ) =[\(\frac{15,3}{M+16}\).(M+34)] : 200 . 100% = 8,55%
=> Giải pt ta được: M=137 (g/mol)
=> M là Ba (Bari)
Cho 8g một oxit kim loại hóa trị 2 tan hết trong 200g dd HCl ( vừa đủ và chưa rõ nồng độ). Cô cạn dd sau phản ứng thu được 19g muối a) xác định công thức oxit b) tính nồng độ % của dd HCl cần dùng
Cho 15,3 gam oxit của kim loại hóa trị II vào nước thu được 200 gam dung dịch bazơ với nồng độ 8,55%. Công thức hóa học của oxit trên là?
Con chưa hiểu câu này thầy ơi:((
Gọi CTHH của oxit là $RO$
$RO + H_2O \to R(OH)_2$
$m_{R(OH)_2} = 200.8,55\% = 17,1(gam)$
Theo PTHH : $n_{RO} = n_{R(OH)_2}$
$\Rightarrow \dfrac{15,3}{R + 17} = \dfrac{17,1}{R + 34}$
$\Rightarrow R = 137(Bari)$
Vậy CTHH của oxit là $BaO$