Hai bình khí lí tưởng cùng nhiệt độ. Bình B có dung tích gấp đôi bình A, có số phân tử bằng nửa số phân tử trong bình A, Mỗi phân tử khí trong bình B có khối lượng gấp đôi khối lượng mỗi phân tử khí trong bình A. Áp suất khí trong bình B so với áp suất khí trong bình A là:...?

Những câu hỏi liên quan
Bốn bình có thể tích và khối lượng bằng nhau, mỗi bình đựng 1 trong các khí sau: hiđro,oxi,cacbonic,amoniac.Hãy cho biết:
a, Số phân tử mỗi bình trong các chát có bằng nhau ko?giải thích?
b,Số nguyên tử ở bình nào nhiều nhất,giải thích?
c,Khối lượng các chất có trong bình cod bằng nhau ko?giải thích?
Biết các khí trên đo ở nhiệt độ và áp suất
a) Thể tích khí trong mỗi bình bằng nhau ➝ số mol khí bằng nhau ➝ số phân tử trong mỗi bình bằng nhau.
b) Mỗi phân tử lại được tạo thành từ số lượng nguyên tử khác nhau.
H2, O2 được tạo thành từ hai nguyên tử
CO2 được tạo thành từ ba nguyên tử
NH3 được tạo thành từ bốn nguyên tử
➝ Số phân tử là bằng nhau, NH3 được tạo thành từ nhiều nguyên tử nhất, nên số nguyên tử ở bình chứa NH3 là lớn nhất.
c) Khối lượng các chất trong mỗi bình không bằng nhau. Chỉ có số mol các chất bằng nhau, còn phân tử khối các chất khác nhau.
Đúng 2
Bình luận (0)
bốn bình có thể tích bằng nhau, mỗi bình đựng 1 trong các khí sau: H2, O2, N2 và CO2. Hãy cho biết: a) Số phân tử của mỗi khí có trong bình có bằng nhau không? Giải thích. b) Số mol chất có trong mỗi bình có bằng nhau không? Giải thích? c) Khối lượng khí trong các bình có bằng nhau không? Nếu không bằng nhau thì bình đựng khí nào có khối lượng lớn nhất, nhỏ nhất? (Biết các khí đo trong cùng điều kiện nhiệt độ và áp suất)
Đọc tiếp
bốn bình có thể tích bằng nhau, mỗi bình đựng 1 trong các khí sau: H2, O2, N2 và CO2. Hãy cho biết:
a) Số phân tử của mỗi khí có trong bình có bằng nhau không? Giải thích.
b) Số mol chất có trong mỗi bình có bằng nhau không? Giải thích?
c) Khối lượng khí trong các bình có bằng nhau không? Nếu không bằng nhau thì bình đựng khí nào có khối lượng lớn nhất, nhỏ nhất? (Biết các khí đo trong cùng điều kiện nhiệt độ và áp suất)
a) Số phân tử khí trong mỗi bình bằng nhau vì có thể tích bằng nhau nên tương ứng số mol các chất khí bằng nhau
b) Số mol trong các chất ở mỗi bình bằng nhau vì thể tích các chất bằng nhau và đều được đo ở cùng điều kiện nhiệt độ và áp suất
c) khối lượng chất khí trong mỗi bình không bằng nhau vì khối lượng phân tử của mỗi chất không giống nhau
\(m_{CO_2}>m_{O_2}>m_{N_2}>m_{H_2}\)
Đúng 4
Bình luận (0)
a) Số phân tử của mỗi khí trong bình đều bằng nhau do các bình có thể tích bằng nhau
b) Số mol chất trong mỗi bình bằng nhau do số phân tử của mỗi chất bằng nhau (câu a)
c) Không bằng nhau do phân tử khối của chúng khác nhau
PTK của H2 = 2 đvC => khối lượng nhỏ nhất
_________O2 = 32 đvC
_________N2 = 28 đvC
_________CO2 = 44 đvC =>khối lượng lớn nhất
Đúng 1
Bình luận (0)
Bốn bình có thể tích và khối lượng bằng nhau, mỗi bình đựng một trong các khí sau: hiđro,oxi,cacbonic,amoniac.Hãy cho biết:
a,số phân tử của mỗi chất trong các bình có bằng nhau ko?giải thích?
b, số nguyên tử ở bình nào nhiều nhất?giải thích?
c,khối lượng các chất trong các bình có bằng nhau ko?giải thích?
Một bình kín chứa
N
3
,
01
.
10
23
phân tử khí heli.a/ Tính khối lượng khí Heli chứa trong bình.b/ Biết nhiệt độ khí là
0
∘
C
và áp suất khí trong bình là 1atm (
1
,
013
.
10
5
Pa). Hỏi thể tích của bình là bao nhiêu?
Đọc tiếp
Một bình kín chứa N = 3 , 01 . 10 23 phân tử khí heli.
a/ Tính khối lượng khí Heli chứa trong bình.
b/ Biết nhiệt độ khí là 0 ∘ C và áp suất khí trong bình là 1atm ( 1 , 013 . 10 5 Pa). Hỏi thể tích của bình là bao nhiêu?
a)
Cứ N A phân tử (nguyên tử) He có khối lượng 4g.
Chú ý: N = 3 , 01.10 23 = N A 2
⇒ khối lượng He trong bình: m = 4 2 = 2 g
b)
Trong điều kiện nhiệt độ và áp suất như trên (ĐKTC),
thể tích của 1 mol He là V 0 = 22,1 lít. Vì lượng khí He
trong bình chỉ là 0,5 mol nên thể tích của bình là:
V = V 0 2 = 11 , 2 lít.
Đúng 0
Bình luận (0)
Hỗn hợp A gồm 3 hiđrocacbon ở thể khí: CxH2x+2, CyH2y và CzH2z-2, trong đó thể tích CzH2z-2 gấp 3 lần thể tích CxH2x+2. Đốt cháy hoàn toàn 1,344 lít hỗn hợp A (đktc), toàn bộ sản phẩm cháy cho qua bình đựng Ca(OH)2 dư, thấy khối lượng bình tăng 9,56 gam và xuất hiện 16 gam kết tủa trắng. a) Tính thành phần % theo thể tích của mỗi hiđrocacbon trong hỗn hợp A. Biết rằng thể tích các khí đo cùng điều kiện nhiệt độ và áp suất. b) Xác định công thức phân tử của 3 hiđrocacbon, biết rằng trong hỗn hợp...
Đọc tiếp
Hỗn hợp A gồm 3 hiđrocacbon ở thể khí: CxH2x+2, CyH2y và CzH2z-2, trong đó thể tích CzH2z-2 gấp 3 lần thể tích CxH2x+2. Đốt cháy hoàn toàn 1,344 lít hỗn hợp A (đktc), toàn bộ sản phẩm cháy cho qua bình đựng Ca(OH)2 dư, thấy khối lượng bình tăng 9,56 gam và xuất hiện 16 gam kết tủa trắng.
a) Tính thành phần % theo thể tích của mỗi hiđrocacbon trong hỗn hợp A. Biết rằng thể tích các khí đo cùng điều kiện nhiệt độ và áp suất.
b) Xác định công thức phân tử của 3 hiđrocacbon, biết rằng trong hỗn hợp A có 2 hiđrocacbon có cùng số nguyên tử C và đều bằng một nửa số nguyên tử C của hiđrocacbon còn lại.
a)

CxH2x +2 + (3x+1)/2O2 → t ∘ x CO2 + (x+1) H2O
CyH2y + 3y/2O2 → t ∘ y CO2 + y H2O
CzH2z-2 + (3z-1)/2O2 → t ∘ zCO2 + (z-1) H2O
Khi đốt cháy hỗn hợp A thu được CO2 và H2O. Cho sản phẩm qua Ca(OH)2 dư thì khối lượng bình tăng chính là khối lượng của H2O và CO2
=> mCO2 + mH2O = 9,56 (g)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 16/100 = 0,16 (mol)
=> nH2O = (9,56 – 0,16.44)/18 = 0,14 (mol)
Ta có hệ phương trình:
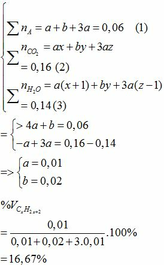
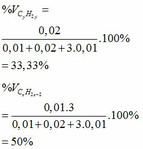
b)
thế a, b vào (2) => 0,01x + 0,02y + 3.0,01z = 0,16
=> x + y +3z = 16
Vì có 2 hidrocacbon bằng nhau và bằng một nửa số cacbon của hidrocacbon còn lại nên có các trường hợp sau:
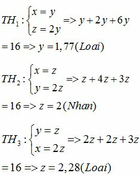
Vậy công thức phân tử của 3 hidrocacbon là: C2H6; C2H4 và C2H2
Đúng 0
Bình luận (0)
Một bình kín dung tích 5,6 lít có chứa hỗn hợp hơi của hai ancol đơn chức và 3,2 g
O
2
. Nhiệt độ trong bình là
109
,
2
°
C
, áp suất trong bình là 0,728 atm.Bật tia lửa điện để đốt cháy hoàn toàn hai ancol, sau phản ứng nhiệt độ trong bình là
136
,
5
°
C
và áp suất là p atm.Dẫn các chất trong bình sau phản ứng qua bình (1) đựng
H...
Đọc tiếp
Một bình kín dung tích 5,6 lít có chứa hỗn hợp hơi của hai ancol đơn chức và 3,2 g O 2 . Nhiệt độ trong bình là 109 , 2 ° C , áp suất trong bình là 0,728 atm.
Bật tia lửa điện để đốt cháy hoàn toàn hai ancol, sau phản ứng nhiệt độ trong bình là 136 , 5 ° C và áp suất là p atm.
Dẫn các chất trong bình sau phản ứng qua bình (1) đựng H 2 S O 4 đặc (dư), sau đó qua bình (2) đựng dung dịch NaOH (dư), thấy khối lượng bình (1) tăng 1,26 g, khối lượng bình (2) tăng 2,2 g.
1. Tính p, biết rằng thể tích bình không đổi.
2. Xác định công thức phân tử, công thức cấu tạo, phần trăm khối lượng và gọi tên từng chất trong hỗn hợp ancol biết rằng số mol của ancol có phân tử khối nhỏ hn gấp 2 lần số mol của ancol có phân tử khối lớn hơn.
1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
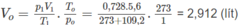
Số mol các chất trong bình trước phản ứng là:
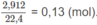
Số mol O2 = 0,1 (mol) ⇒ Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
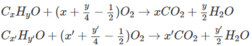
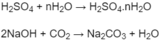
Số mol
H
2
O
là: 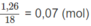
Số mol
C
O
2
là: 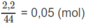
Theo định luật bảo toàn khối lượng :

= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol
O
2
còn dư: 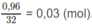
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là: V O = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
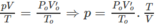
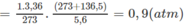
2. Giả sử C x H y O có PTK nhỏ hơn C x ' H y ' O ; như vậy số mol C x H y O sẽ là O 2 và số mol C x ' H y ' O là 0,01.
Số mol C O 2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên: x = 1 ; x' = 3
hoặc x = 2; x' = 1
Cặp x = 2; x' = 1 loại vì trái với điều kiện: C x H y O có PTK nhỏ hơn C x ' H y ' O
Vậy, một ancol là C H 4 O và chất còn lại C 3 H y ' O .
Số mol H 2 O là 0,02.2 + 0,01.(y′/2) = 0,07 (mol).
⇒ y' = 6 ⇒ Ancol còn lại là C 3 H 6 O .
% về khối lượng của C H 4 O hay C H 3 - O H (ancol metylic) :

% về khối lượng của C 3 H 6 O hay C H 2 = C H - C H 2 - O H (a- Oncol anlylic): 100,00% - 52,46% = 47,54%.
Đúng 0
Bình luận (0)
Một bình kín dung tích 11,2 lít có chứa 6,4 g
O
2
và 1,36 g hỗn hợp khí A gồm 2 ankan. Nhiệt độ trong bình là
0
°
C
và áp suất là p1 atm. Bật tia lửa điện trong bình kín đó thì hỗn hợp A cháy hoàn toàn. Sau phản ứng, nhiệt độ trong bình là
136
,
5
°
C
và áp suất là p2 atm.Nếu dẫn các chất trong bình sau phản ứng vào dung dịch
C
a...
Đọc tiếp
Một bình kín dung tích 11,2 lít có chứa 6,4 g O 2 và 1,36 g hỗn hợp khí A gồm 2 ankan. Nhiệt độ trong bình là 0 ° C và áp suất là p1 atm. Bật tia lửa điện trong bình kín đó thì hỗn hợp A cháy hoàn toàn. Sau phản ứng, nhiệt độ trong bình là 136 , 5 ° C và áp suất là p2 atm.
Nếu dẫn các chất trong bình sau phản ứng vào dung dịch C a ( O H ) 2 lấy dư thì có 9 gam kết tủa tạo thành.
1. Tính p1 và p2, biết rằng thể tích bình không đổi.
2. Xác định công thức phân tử và phần trăm thể tích từng chất trong hỗn hợp A, biết rằng số mol của ankan có phân tử khối nhỏ nhiều gấp 1,5 lần số mol của ankan có phân tử khối lớn.
1. Giả sử hỗn hợp A có X mol C n H 2 n + 2 và y mol C m H 2 m + 2 :
(14n + 2)x + (14m + 2)y = 1,36 ⇒ 14(nx + my) + 2(x + y) = 1,36 (1)
Khi đốt hỗn hợp A:
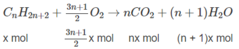
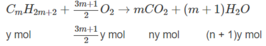
n C O 2 = n C a C O 3 = 0,09(mol)
⇒ nx + my = 0,09 (2)
Từ (1) và (2), tìm được x + y = 0,05.
Số mol O 2 trước phản ứng: n O 2 = 0,2(mol).
Tổng số mol khi trước phản ứng: 0,2 + 0,05 = 0,25 (mol).
Nếu ở đktc thì V O = 0,25.22,4 = 5,6 (lít).
Thực tế V 1 = 11,2 (lít)
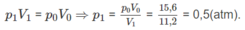
Số mol hơi nước: (n + 1)x + (m + 1)y = nx + my + x + y = 0,14
Số mol O 2 dự phản ứng:
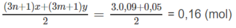
Số mol O 2 còn dư: 0,2 - 0,16 = 0,04 (mol).
Tổng số mol khí sau phản ứng: 0,09 + 0,14 + 0,04 = 0,27 (mol).
Nếu ở đktc thì V ' O = 0,27.22,4 = 6,048 (lít)
Thực tế V 2 = 11,20 (lít)
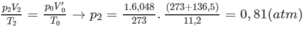
2) Nếu n < m thì x = 1,5y;
Vậy x = 0,03; y = 0,02
0,03n + 0,02m = 0,09 ⇒ 3n + 2m = 9
3n = 9 - 2m 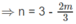
n và m nguyên dương nên m = 3 và n = 1.
C H 4 chiếm 60% thể tích hỗn hợp.
C 3 H 8 chiếm 40% thể tích hỗn hợp.
Đúng 0
Bình luận (0)
Một bình thủy tinh kín có chứa 2 gam khí SO3. Hãy tính:
- Thể tích chất khí đó ở đktc.
- Khối lượng nguyên tố S và nguyên tố O.
- Số nguyên tử mỗi nguyên tố trong phân tử trên.
\(n_{SO_3}=\dfrac{2}{80}=0,025\left(mol\right)\\ V_{SO_3}=0,025.22,4=0,56\left(l\right)\\ m_S=0,025.32=0,8\left(g\right)\\ m_O=0,025.48=1,2\left(g\right)\\ 1nguyêntửS,3nguyêntửO\)
Đúng 0
Bình luận (0)
Crackinh 1 ankan A thu được hỗn hợp sản phẩm B gồm 5 hiđrocacbon có khối lượng mol trung bình là 36,25 gam/mol, hiệu suất phản ứng là 60%. Công thức phân tử của A là (biết rằng số mol khí sinh ra khi crackinh ankan gấp đôi số mol của nó): A. C2H6. B. C5H12. C. C3H8. D. C4H10
Đọc tiếp
Crackinh 1 ankan A thu được hỗn hợp sản phẩm B gồm 5 hiđrocacbon có khối lượng mol trung bình là 36,25 gam/mol, hiệu suất phản ứng là 60%. Công thức phân tử của A là (biết rằng số mol khí sinh ra khi crackinh ankan gấp đôi số mol của nó):
A. C2H6.
B. C5H12.
C. C3H8.
D. C4H10
















