Viết phương trình chữ của các hiện tượng hoá học sau?
a) Đun nóng đường tạo thành than và nước.
b) Nhôm tác dụng với axit sunfuric tạo thành nhôm sunfat và khí hiđro.
Cho 13,5g kẽm tác dụng với dung dịch có chứa 16,3gam axit sunfuric (H2SO4)Sau khi phản ứng kết thúc thu được kẽm sunfat(ZnSO4) và 0. ,3 gam khí hiđro(H2) a)viết phương trình chữ phản ứng b)tính khối lượng nhôm clorua tạo thành
: Viết phương trình chữ của các phản ứng hóa học trong các quá trình biến đổi sau:
a) Đốt cồn trong không khí tạo thành khí cacbonic và nước.
b) Đốt bột nhôm trong không khí, tạo thành nhôm oxit.
c) Điện phân nước, thu được khí hiđro và oxi.
d) Đá vôi bị phân huỷ thành vôi sống và khí cacbonic.
e) Khi đốt phốt pho, chất này hoá hợp với oxi tạo thành chất rắn gọi là anhiđrit photphoric.
f) Ở nhiệt độ cao khí hiđrô hoá hợp với khí oxi sinh ra nước.
Cho a gam nhôm (Al) tác dụng vừa đủ với dung dịch chứa 29,4 gam axit sunfuric H 2 S O 4 . Sau phản ứng thu được muối nhôm sunfat A l 2 S O 4 3 và khí hiđro H 2
Viết phương trình hóa học?
cho 5,4 g nhôm tác dụng với axit sunfuric tạo thành nhôm sunfat và khí hidro
a, viết phương trình phản ứng xảy ra
b, tính thể tích khí hidro sinh ra ở đktc
c, tính khối lượng axit sunfuric cần dùng
d, nếu dẫn toàn bộ lượng khia hidro sinh ra đi qua 16 g đồng (II)oxit(CuO) nung nóng thì chấ nào dư sau phản ứng
a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2--->0,3-------->0,1----------->0,3
b) `V_{H_2} = 0,3.22,4 = 6,72 (l)`
c) `m_{H_2SO_4} = 0,3.98 = 29,4 9g)`
d) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Xét tỉ lệ: 0,2 < 0,3 => H2 dư
làm hộ mình với ạ
Cho 9,6g magie Mg tác dụng với 39,2g axit sunfuric H 2 SO 4 . Sau khi phản ứng kết thúc, tạo thành magie sunfat MgSO 4 và 0,8g khí hiđro H 2 . Hãy viết phương trình hóa học của phản ứng và tính khối lượng magie sunfat tạo thành.
\(PTHH:Mg+H_2SO_4--->MgSO_4+H_2\uparrow\)
Áp dụng ĐLBTKL, ta có:
\(m_{Mg}+m_{H_2SO_4}=m_{MgSO_4}+m_{H_2}\)
\(\Leftrightarrow9,6+39,2=m_{MgSO_4}+0,8\)
\(\Leftrightarrow m_{MgSO_4}=9,6+39,2-0,8=48\left(g\right)\)
PTHH: Mg + H2SO4 \(\rightarrow\) MgSO4 + H2
Theo ĐLBTKL, ta có:
m\(Mg\) \(+m_{H_2SO_4}=m_{MgSO_4}+m_{H_2}\)
\(\Rightarrow m_{MgSO_4}=\left(39,2+9,6\right)-0,8=48g\)
\(PTHH:Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\Rightarrow m_{Mg}+m_{H_2SO_4}=m_{MgSO_4}+m_{H_2}\\ \Rightarrow m_{MgSO_4}=m_{Mg}+m_{H_2SO_4}-m_{H_2}=9,6+39,2-0,8=48\left(g\right)\)
\(PTHH:2Al+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2\)
áp dụng định luật bảo toàn khối lượng ta có
\(m_{Al}+m_{H_2SO_4}=m_{Al_2\left(SO_4\right)_3}+m_{H_2}\\ =>5,4+29,4=34,2+m_{H_2}\\ =>m_{H_2}=0,6\left(g\right)\)
áp dụng định luật bảo toàn khối lượng ta có
Câu 5: Cho 8,1g nhôm tác dụng vừa đủ với dung dịch axit clohidric (HCI) 0,5M thu được nhôm clorua và khí hidro a) Viết phương trình hoá học. Tính thể tích khí hidro tạo thành (ở đktc). b) Tính khối lượng AlCl, tạo thành. c)Tính thể tích của dung dịch axit clohidric cần dùng.
a) 2Al + 6HCl → 2AlCl3 + 3H2
b) n Al= 8,1/27 =0,3(mol)
n H2 = 3/2 n Al = 0,45(mol)
V H2 = 0,45.22,4= 10,08 lít
c) n AlCl3 = n Al = 0,3 mol
m AlCl3 = 0,3.133,5 = 40,05(gam)
d) n HCl = 2n H2 = 0,9(mol)
=> V dd HCl = 0,9/0,5 = 1,8(lít)
Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau :
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49g axit sunfuric nguyên chất tác dụng với 60g nhôm oxit. Sau phản ứng chất nào còn dư ? Lượng dư của chất đó là bao nhiêu ?
Phương trình hóa học của phản ứng:
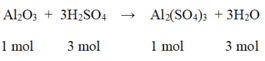
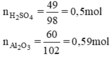
So sánh tỉ lệ 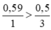 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
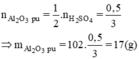
mAl2O3 (dư) = 60 - 17 = 43(g)
Biết rằng kim loại nhôm tác dụng với axit sunfuric H2SO4 tạo ra nhôm sunfat Al2(SO4)3 và khí hiđro
A) lậpphương trình hóa học của phản ứng
B) cho biết tỉ lệ số nguyên tử nhôm lần lượt với số phân tử của 3 chất khác trong phản ứng
a) 2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2
b) Số nguyên tử Al : số phân tử H2SO4 = 2 : 3
Số nguyên tử Al : số phân tử Al2(SO4)3 = 2 : 1
Số nguyên tử Al : số phân tử H2 = 2 : 3
a) 2Al+ 3H2SO4 -> Al2(SO4)3 +3 H2
b) Tỉ lệ của:
- Nguyên tử Al với Số phân tử H2SO4
2:3
- Nguyên tử Al với số phân tử Al2(SO4)3
2:1
- Nguyên tử Al với số phân tử H2
2:3
a/ PTHH: 2Al + 3H2SO4 ===> Al2(SO4)3 + 3H2
b/ Tỉ lệ:
Số nguyên tử nhôm : số phân tử H2SO4 = 2 : 3Số nguyên tử nhôm : số phân tử Al2(SO4)3 = 2 : 1Số nguyên tử nhôm : số phân tử H2 = 2 : 3