tính khối lượng của nguyên tố oxi trong:
a.12 gam NaOH
b.40 gam Fe2(SO4)3
c.8,2 gam Na3PO4
Bài 1: Tính Khối Lượng Của Nguyên Tố Oxi có trong mỗi hợp chất sau:
1. 18 gam nước
2. 2,2 gam CO2
3. 8 gam CuSO4
4. 2 gam Fe2(SO4)3
Bài 1: Tính Khối Lượng Của Nguyên Tố Oxi có trong mỗi hợp chất sau:
1. 18 gam nước
\(n_{H_2O}=\dfrac{18}{18}=1\left(mol\right)\Rightarrow n_O=1.1=1\left(mol\right)\)
=> mO = 1.16 = 16 (g)
2. 2,2 gam CO2
\(n_{CO_2}=\dfrac{2,2}{44}=0,05\left(mol\right)\Rightarrow n_O=0,05.2=0,1\left(mol\right)\)
mO = 0,1 .16 =1x6(g)
3. 8 gam CuSO4
\(n_{CuSO_4}=\dfrac{8}{160}=0,05\left(mol\right)\Rightarrow n_O=0,05.4=0,2\left(mol\right)\)
=> mO= 0,2.16= 3,2(g)
4. 2 gam Fe2(SO4)3
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{2}{400}=0,005\left(mol\right)\Rightarrow n_O=0,005.12=0,06\left(mol\right)\)
=> mO= 0,06.16 = 0,96(g)
Hỗn hợp gồm MgSO4 và Fe2(SO4)3, trong đó % khối lượng nguyên tố oxi là 25%.
a/ Tính % khối lượng nguyên tố lưu huỳnh trong hỗn hợp.
b/ Tính % khối lượng nguyên tố oxi trong hỗn hợp.
c/ Từ 64 gam hỗn hợp, có thể điều chế được bao nhiêu gam hỗn hợp Mg và Fe? (2 cách).
a)
Giả sử có 100 gam hỗn hợp
\(m_O=\dfrac{25.100}{100}=25\left(g\right)\)
=> \(n_O=\dfrac{25}{16}=1,5625\left(mol\right)\)
Mà nO = 4.nS
=> \(n_S=\dfrac{1,5625}{4}=\dfrac{25}{64}\left(mol\right)\)
\(\%m_S=\dfrac{\dfrac{25}{64}.32}{100}.100\%=12,5\%\)
b) Đề bài cho rồi mà bn :)
c)
C1: %mkim loại = \(100\%-12,5\%-25\%=62,5\%\)
=> mkim loại = \(\dfrac{64.62,5}{100}=40\left(g\right)\)
C2:
\(m_S=\dfrac{64.12,5}{100}=8\left(g\right)\)
\(m_O=\dfrac{64.25}{100}=16\left(g\right)\)
=> mkim loại = 64 - 8 - 16 = 40 (g)
a/ Tính khối lượng các nguyên tố có trong 0,3 mol Ca(NO3)2.
b/ Tính khối lượng Fe2(SO4)3 có 9,6 gam oxi.
c/ Tính thể tích H2 (đktc) có số phân tử bằng số nguyên tử oxi có trong 3,2 gam CuSO4.
Câu a.
\(M_{Ca\left(NO_3\right)_2}=164\)g/mol
\(m_{Ca\left(NO_3\right)_2}=0,3\cdot164=49,2g\)
\(\%Ca=\dfrac{40}{164}\cdot100\%=24,39\%\)
\(m_{Ca}=\%Ca\cdot49,2=12g\)
\(\%N=\dfrac{14\cdot2}{164}\cdot100\%=17,07\%\)
\(m_N=\%N\cdot49,2=8,4g\)
\(m_O=49,2-12-8,4=28,8g\)
Các câu sau em làm tương tự nhé!
a/ Tính khối lượng các nguyên tố có trong 0,3 mol Ca(NO3)2.
b/ Tính khối lượng Fe2(SO4)3 có 9,6 gam oxi.
c/ Tính thể tích H2 (đktc) có số phân tử bằng số nguyên tử oxi có trong 3,2 gam CuSO4.
a)\(n_{Ca\left(NO_3\right)_2}=0,3mol\)
\(n_{Ca}=n_{Ca\left(NO_3\right)_2}=0,3mol\)
\(m_{Ca}=0,3\cdot40=12g\)
\(n_N=2n_{Ca\left(NO_3\right)_2}=2\cdot0,3=0,6mol\)
\(m_N=0,6\cdot14=8,4g\)
\(n_O=6n_{Ca\left(NO_3\right)_2}=6\cdot0,3=1,8mol\)
\(m_O=1,8\cdot16=28,8g\)
b)\(n_O=\dfrac{9,6}{16}=0,6mol\)
Mà \(n_O=12n_{Fe_2\left(SO_4\right)_3}\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,6}{12}=0,05mol\)
\(\Rightarrow m=20g\)
c)\(n_{CuSO_4}=\dfrac{3,2}{160}=0,02mol\)
\(n_O=4n_{CuSO_4}=0,08mol=n_{H_2}\)
\(V_{H_2}=0,08\cdot22,4=1,792l\)
Đốt cháy hoàn toàn 8,2 gam hợp chất hữu cơ X, thu được 3,36 lít CO 2 (đktc), 5,3 gam Na 2 CO 3 và 2,7 gam H 2 O . Khối lượng nguyên tố oxi trong 8,2 gam X là
A. 6,1 gam
B. 3,8 gam
C. 5,5 gam
D. 3,2 gam
Đáp án D
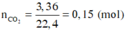
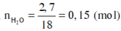
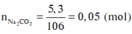
mX = mC + mH + mO + mNa = 12 ( n N a 2 C O 3 + n C O 2 ) + 2 n H 2 O + 23.2. n N a 2 C O 3 + m O
Þ 12.(0,15 + 0,05) + 2.0,15 + 46.0,05 + mO = 8,2
Þ mO = 3,2 gam
a/ Tính khối lượng các nguyên tố có trong 0,6 mol (NH4)3PO4.
b/ Tính khối lượng Al2(SO4)3 có 6,4 gam S.
c/ Tính thể tích CO2 (đktc) có số phân tử bằng số nguyên tử oxi có trong 20,52 gam Al2(SO4)3.
\(a,n_{\left(NH_4\right)_3PO_4}=0,6\left(mol\right)\\ \Rightarrow n_N=0,6.3=1,8\left(mol\right)\Rightarrow m_N=1,8.14=25,2\left(g\right)\\ n_H=4.3.0,6=7,2\left(mol\right)\Rightarrow m_H=7,2.1=7,2\left(g\right)\\ n_P=n_{hc}=0,6\left(mol\right)\Rightarrow m_P=0,6.31=18,6\left(g\right)\\ n_O=4.0,6=2,4\left(mol\right)\Rightarrow m_O=2,4.16=38,4\left(g\right)\)
\(b,n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\Rightarrow n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.0,2=\dfrac{1}{15}\left(mol\right)\\ \Rightarrow m_{Al_2\left(SO_4\right)_3}=342.\dfrac{1}{15}=22,8\left(g\right)\\ c,n_{Al_2\left(SO_4\right)_3}=\dfrac{20,52}{342}=0,06\left(mol\right)\\ n_O=4.3.0,06=0,72\left(mol\right)\\ \Rightarrow n_{CO_2}=\dfrac{0,72}{2}=0,36\left(mol\right)\Rightarrow V_{CO_2\left(đktc\right)}=0,36.22,4=8,064\left(l\right)\)
Số hạt phân tử oxi bằng số hạt nguyên tử lưu huỳnh có trong 8 gam Fe2(SO4)3.Tính khối lượng KMnO4 cần để điều chế được số phân tử oxi trên.
nS = 8/32 = 0,25 (mol)
nFe2(SO4)3 = 0,25/3 = 1/12 (mol)
=> nO2 = 1/12 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 1/12 . 2 = 1/6 (mol)
mKMnO4 = 1/6 . 158 = 79/3 (g)
cho 32 gam Fe2(SO4)3
a. hãy tính số nguyên tử có trong lượng phân tử chất đó
b. tính thể tích khí Oxi ở đktc để có số nguyên tử oxi bằng số nguyên tử oxi có trong 32 gam hỗn hợp chất trên
Hỗn hợp X gồm CuSO4, FeSO4, Fe2(SO4)3 có chứa 20% theo khối lượng nguyên tố lưu huỳnh. Từ 64 gam hỗn hợp X có thể điều chế tối đa được m gam hỗn hợp 2 kim loại. Tính giá trị của m.
\(m_{SO_4^{2-}}=m_S=\dfrac{64\cdot20\%}{100\%}=12,8g\Rightarrow n_S=n_{SO_4^{2-}}=0,4mol\)
Khối lượng kim loại:
\(m=64-m_{SO_4^{2-}}=64-0,4\cdot96=25,6g\)