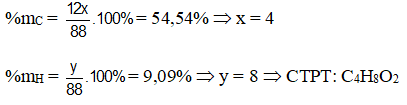Hợp chất hữu cơ X chứa 54,54% C, 9,1% H, còn lại là Oxi. Biết M=88 đvC. Tìm CTHH

Những câu hỏi liên quan
26. Một hợp chất hữu cơ X có thành phần phần trăm về khối lượng các nguyên tố như sau : C(54,54%) , H(9,1%) còn lại là oxi. Biết rằng tỉ khối hơi của X so vs CO2 là 2. Tìm công thức phân tử của X?
Xem chi tiết
%O = 100% -%C -%H = 100% - 54,54% - 9,1% = 36,36%
\(M_X = 2M_{CO_2} = 2.44 = 88(đvC)\)
Số nguyên tử Cacbon = \(\dfrac{88.54,54\%}{12}= 4\)
Số nguyên tử Hidro = \(\dfrac{88.9,1\%}{1} = 8\)
Số nguyên tử Oxi = \(\dfrac{88.36,36\%}{16} = 2\)
Vậy CTPT của X : C4H8O2
Đúng 1
Bình luận (0)
hợp chất X có chứa 54,54%C, 9,09%H và còn lại là nguyên tố oxi về khối lượng. Tỉ khối của T so với H2 bằng 44. Tìm CTHH của hợp chất T
1/ thành phần % của hợp chất hữu cơ có chứa C,H,O theo thứ tự là 62,1% ;10,3% ;27,6% .M =60 công thức của hợp chất nguyên của hợp chất này là 2/ hợp chất X có phần trăm khối lượng C,H,O lần lượt bằng 54,54%;9,1%;36,36% khối lượng mol phân tử của X bằng 88g/mol . công thức phân tử
Phân tích hợp chất hữu cơ A thấy chứa % theo khối lượng như sau: 40%C; 6,67%H, còn lại là của Oxi. Xác định CTPT A biết đvC. A. C2H6O. B. C2H6O2. C. C2H4O2. D. C3H8O.
Đọc tiếp
Phân tích hợp chất hữu cơ A thấy chứa % theo khối lượng như sau: 40%C; 6,67%H, còn lại là của Oxi. Xác định CTPT A biết đvC.
A. C2H6O.
B. C2H6O2.
C. C2H4O2.
D. C3H8O.
Phân tích hợp chất hữu cơ A thấy chứa % theo khối lượng như sau: 40%C; 6,67%H, còn lại là của Oxi. Xác định CTPT A biết MA 60 đvC. A. C2H6O B. C2H6O2 C. C2H4O2 D. C3H8O
Đọc tiếp
Phân tích hợp chất hữu cơ A thấy chứa % theo khối lượng như sau: 40%C; 6,67%H, còn lại là của Oxi. Xác định CTPT A biết MA= 60 đvC.
A. C2H6O
B. C2H6O2
C. C2H4O2
D. C3H8O
Một chất hữu cơ X có thành phần khối lương các nguyên tố là: 54,5% C; 9,1% H; 36,4% O. Biết X có khối lượng phân tử là 88 đvC. Công thức phân tử của X ?
\(m_C=\dfrac{88.54,5}{100}=48\left(g\right)=>n_C=\dfrac{48}{12}=4\left(mol\right)\)
\(m_H=\dfrac{88.9,1}{100}=8\left(g\right)=>n_H=\dfrac{8}{1}=8\left(mol\right)\)
\(m_O=\dfrac{36,4.88}{100}=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: C4H8O2
Đúng 1
Bình luận (1)
Công thức phân tử của hợp chất hữu cơ A có thành phần 54,5%C, 9,1%H, còn lại là oxi. Biết 0,88gam hơi chất A chiếm thể tích 224ml(đktc).
\(\%m_O=100\%-54,5\%-9,1\%=36,4\%\)
Ta có \(224(ml)=0,224(l)\)
\(\Rightarrow n_A=\dfrac{0,224}{22,4}=0,01(mol)\\ \Rightarrow M_A=\dfrac{0,88}{0,01}=88(g/mol)\)
Đặt \(CTPT\) của A là \(C_xH_yO_z\)
\(\Rightarrow x:y:z=\dfrac{\%m_C}{M_C}:\dfrac{\%m_H}{M_H}:\dfrac{\%m_O}{M_O}=\dfrac{54,5}{12}:\dfrac{9,1}{1}:\dfrac{36,4}{16}\\ \Rightarrow x:y:z\approx 2:4:1\)
\(\Rightarrow CTPT\) của A có dạng \((C_2H_4O)_n\)
Mà \(M_A=88(g/mol)\)
\(\Rightarrow (12.2+4+16).n=88\\ \Rightarrow n=2\)
Vậy CTPT của A là \(C_4H_8O_2\)
Đúng 3
Bình luận (0)
\(n_A=\dfrac{0,224}{22,4}=0,01\left(mol\right)=>M_A=\dfrac{0,88}{0,01}=88\left(g/mol\right)\)
\(m_C=\dfrac{54,5.88}{100}=48\left(g\right)=>n_C=\dfrac{48}{12}=4\left(mol\right)\)
\(m_H=\dfrac{9,1.88}{100}=8\left(g\right)=>n_H=\dfrac{8}{1}=8\left(mol\right)\)
\(m_O=88-48-8=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTPT: C4H8O2
Đúng 1
Bình luận (0)
bài 1 : một hợp chất có PTK là 106, trong đó thành phần phần trăm theo khối lượng gồm 43,4%Na, 11,32%C,còn lại là Oxi. tìm CTHH của hợp chất đó
bài 2 : một hợp chất X có % khối lượng C,H,O lần lượt là: 54,54% ; 9,1% ; 36,36%. X có tỉ khối so vói CO2 bằng 2.. Tìm công thức của X?
mọi giúp mk nhanh đc ko ạ
Câu 4: Hợp chất A chứa 40% khối lượng nguyên tố lưu huỳnh, còn lại là nguyên tố oxi. Biết M h/c = 80 gam / mol. Tìm CTHH và cho biết tên của hợp chất A đó.
mS = 80 . 40% = 32 (g)
nS = 32/32 = 1 (mol)
mO = 80 - 32 = 48 (g)
nO = 48/16 = 3 (mol)
CTHH: SO3
Đúng 2
Bình luận (0)
mS = 80 . 40% = 32 (g)
nS = 32/32 = 1 (mol)
mO = 80 - 32 = 48 (g)
nO = 48/16 = 3 (mol)
CTHH: SO3
chúc bn học tốt ![]()
Đúng 0
Bình luận (0)