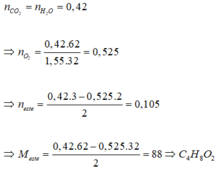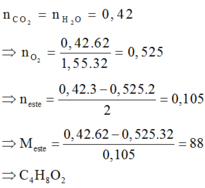Đốt cháy hoàn toàn 1 gam R cần 0,7 lit oxi(đktc), thu được hợp chất X. Tìm công thức R, X.

Những câu hỏi liên quan
Đốt cháy hoàn toàn 1 g nguyên tố R cần 0,7 lít õi(đktc) ,thu được hợp chất X Tìm công thức
\(n_{O_2}=\dfrac{0.7}{22.4}=\dfrac{1}{32}\left(mol\right)\)
\(4R+nO_2\underrightarrow{^{^{t^0}}}2R_2O_n\)
\(\dfrac{1}{8n}..\dfrac{1}{32}\)
\(M_R=\dfrac{1}{\dfrac{1}{8n}}=8n\)
\(n=4\Rightarrow R=32\)
\(CT:S\)
Đúng 3
Bình luận (0)
PTHH: \(4X+nO_2\xrightarrow[]{t^o}2X_2O_n\) (n là hóa trị của X)
Ta có: \(n_{O_2}=\dfrac{0,7}{22,4}=0,03125\left(mol\right)\)
\(\Rightarrow n_X=\dfrac{0,125}{n}\left(mol\right)\) \(\Rightarrow M_X=8n\)
Ta thấy với \(n=4\) thì \(M_X=32\) (Lưu huỳnh)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 1g nguyên tố R, cần 0,7 l oxi(dktc) thu đc hợp chất X. tìm công thức R,X
Gọi hóa trị của R là n
\(n_{O_2}=\dfrac{0,7}{22,4}=0,03125\left(mol\right)\)
\(4R+nO_2\rightarrow\left(t^o\right)2R_2O_n\)
\(\dfrac{0,125}{n}\) 0,03125 ( mol )
\(M_R=\dfrac{1}{\dfrac{0,125}{n}}=8n\)
Chỉ có `n=4` thỏa mãn `->` R là Lưu huỳnh ( S ) `->` X là `SO_2`
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn a gam một este X thu được 9,408 lit CO2 (đktc) và 7,56 gam H2O. Khối lượng hỗn hợp CO2 và H2O thu được ở trên gấp 1,55 lần khối lượng oxi cần để đốt cháy hết X. X có công thức phân tử là A. C2H4O2 B. C3H6O2 C. C3H4O2 D. C4H8O2
Đọc tiếp
Đốt cháy hoàn toàn a gam một este X thu được 9,408 lit CO2 (đktc) và 7,56 gam H2O. Khối lượng hỗn hợp CO2 và H2O thu được ở trên gấp 1,55 lần khối lượng oxi cần để đốt cháy hết X. X có công thức phân tử là
A. C2H4O2
B. C3H6O2
C. C3H4O2
D. C4H8O2
Đốt cháy hoàn toàn a gam một este X thu được 9,408 lit CO2 (đktc) và 7,56 gam H2O. Khối lượng hỗn hợp CO2 và H2O thu được ở trên gấp 1,55 lần khối lượng oxi cần để đốt cháy hết X. X có công thức phân tử là A. C2H4O2 B. C3H6O2 C. C3H4O2 D. C4H8O2
Đọc tiếp
Đốt cháy hoàn toàn a gam một este X thu được 9,408 lit CO2 (đktc) và 7,56 gam H2O. Khối lượng hỗn hợp CO2 và H2O thu được ở trên gấp 1,55 lần khối lượng oxi cần để đốt cháy hết X. X có công thức phân tử là
A. C2H4O2
B. C3H6O2
C. C3H4O2
D. C4H8O2
Bài 6 Đốt cháy 16,8 gam sắt trong bình chứa 6,72 lit oxi (đktc) thu được oxit sắt từ.a. Viết PTHH?b. Tính khối lượng sản phẩm thu được?Bài 7: Đốt cháy hoàn toàn Photpho trong bình chứa 1,12 lit oxi (dktc) thu được hợp chất có công thức P2O5.a. Viết phương trình hóa học? b. Tính khối lượng sản phẩm thu được?c. Tính khối lượng Kali clorat KC1O, cần dùng để điều chế được lượng oxi dùng cho phản ứng trên?
Đọc tiếp
<Bài 6 Đốt cháy 16,8 gam sắt trong bình chứa 6,72 lit oxi (đktc) thu được oxit sắt từ.
a. Viết PTHH?
b. Tính khối lượng sản phẩm thu được?
Bài 7: Đốt cháy hoàn toàn Photpho trong bình chứa 1,12 lit oxi (dktc) thu được hợp chất có công thức P2O5.
a. Viết phương trình hóa học? b. Tính khối lượng sản phẩm thu được?
c. Tính khối lượng Kali clorat KC1O, cần dùng để điều chế được lượng oxi dùng cho phản ứng trên?
Xem thêm câu trả lời
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của XCâu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của XCâu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC 40% ; %mH 6,67% còn lại là oxi.Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Đọc tiếp
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và
10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của X
Câu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.
Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X
Câu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 40% ; %mH = 6,67% còn lại là oxi.
Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Câu 7:
\(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\)
Bảo toàn C: nC = 0,6 (mol)
Bảo toàn H: nH = 1,2 (mol)
=> \(n_O=\dfrac{10,8-0,6.12-1,2}{16}=0,15\left(mol\right)\)
=> nC : nH : nO = 0,6 : 1,2 : 0,15 = 4:8:1
=> CTPT: (C4H8O)n
Mà M = 2,25.32 = 72(g/mol)
=> n = 1
=> CTPT: C4H8O
Câu 6
\(n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn C: nC = 0,25 (mol)
Bảo toàn H: nH = 0,6 (mol)
=> \(n_O=\dfrac{4,4-0,25.12-0,6.1}{16}=0,05\left(mol\right)\)
nC : nH : nO = 0,25 : 0,6 : 0,05 = 5:12:1
=> CTPT: (C5H12O)n
Mà M = 44.2=88(g/mol)
=> n = 1
=> CTPT: C5H12O
Câu 8:
MX = 1,875.32 = 60 (g/mol)
Giả sử có 1 mol chất X => mX = 60.1 = 60 (g)
\(m_C=\dfrac{60.40}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{60.6,67}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
\(m_O=60-24-4=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> Trong 1 mol X chứa 2 mol C, 4 mol H, 2 mol O
=> CTPT: C2H4O2
Đúng 2
Bình luận (0)
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của XCâu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của XCâu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC 40% ; %mH 6,67% còn lại là oxi.Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Đọc tiếp
Câu 7: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X ( C, H, O) thu được 13,44 lít CO2 (đktc) và
10,8 gam H2 O. Biết tỉ khối của X so với khí oxi bằng 2,25. Công thức phân tử của X
Câu 6: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O.
Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X
Câu 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 40% ; %mH = 6,67% còn lại là oxi.
Tỉ khối hơi của X so với khí oxi bằng 1,875. Công thức phân tử của X
Đốt cháy hoàn toàn m gam một hợp chất X, cần dùng hết 10,08 lít khí oxi (ở đktc). Sau khi phản ứng kết thúc, chỉ thu được 13,2 gam khí CO2 và 7,2 gam H2O.
a. Tìm m và xác định công thức hóa học của X (biết công thức dạng đơn giản chính là công thức hóa học của X).
b. Viết phương trình hóa học của phản ứng đốt cháy X.
a, \(n_{O_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT KL, có: mX + mO2 = mCO2 + mH2O
⇒ m = mX = 13,2 + 7,2 - 0,45.32 = 6 (g)
Ta có: \(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\Rightarrow n_H=0,4.2=0,8\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,8.1 = 4,4 (g) < mX
→ X gồm C, H và O.
⇒ mO = 6 - 4,4 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Gọi CTPT của X là CxHyOz
⇒ x:y:z = 0,3:0,8:0,1 = 3:8:1
Vậy: CTPT của X là C3H8O
b, \(C_3H_8O+\dfrac{9}{2}O_2\underrightarrow{t^o}3CO_2+4H_2O\)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 48 gam một hợp chất A thu được 32 gam Fe2O3 và 17,92 lit khí Sunfurơ (đktc).
a) Lập công thức phân tử của A.
\(CT:Fe_xS_y\)
\(n_{Fe_2O_3}=\dfrac{32}{160}=0.2\left(mol\right)\Rightarrow n_{Fe}=0.2\cdot2=0.4\left(mol\right)\)
\(n_{SO_2}=\dfrac{17.92}{22.4}=0.8\left(mol\right)\Rightarrow n_S=0.8\left(mol\right)\)
\(x:y=0.4:0.8=1:2\)
\(CT:FeS_2\)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 1 hidrocacbon x thu được 2,688 lit co2 (đktc) và 4,32 gam nước. công thức phân tử của x là
\(n_{CO_2} = \dfrac{2,688}{22,4} = 0,12 < n_{H_2O} = \dfrac{4,32}{18} = 0,24(mol)\)
Do đó, X là hidrocacbon no.(CnH2n+2)
Ta có:
\(n_X = n_{H_2O} - n_{CO_2} = 0,24 - 0,12 = 0,12(mol)\\ \Rightarrow n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,12}{0,12} = 1\)
Vậy ,X là CH4
Đúng 2
Bình luận (0)